서 론
최근 스포츠를 즐기는 인구가 늘어나면서 엘리트 선수들뿐만 아니라 일반인들도 운동 중 상해를 입는 경우가 증가하고 있다. 운동 상해를 경험하게 되는 상황은 자신의 체력보다 높은 강도의 운동을 과도하게 실시하거나 갑작스럽게 익숙하지 않은 동작의 운동을 수행하였을 때 발생하게 되며(Clarkson & Hubal, 2002; Marginson et al., 2005), 운동 중 상해를 입었을 경우 다시 운동을 참여하는데 장시간이 소요된다.
운동 상해의 한 종류인 근육 손상의 경우 단축성 수축 운동 보다 근육의 길이가 늘어나면서 수축하는 형태인 신장성 운동에서 더 취약한 것으로 알려져 있으며(Brentano & Martins Kruel, 2011) 근육 손상 관련 연구의 운동 프로토콜로 많이 사용되고 있다. 지금까지의 선행연구에 따르면, 운동유발성 근육 손상 관련 연구에서 사용되고 있는 신장성 운동의 종류는 트레드밀을 이용한 내리막 달리기(Park & Lee, 2015)와 등속성 장비를 활용하여 팔꿈치 굴근(Nguyen et al., 2009)과 무릎 신근(Hicks et al., 2016) 부위의 신장성 운동, 그리고 시합 상황(Russell et al., 2016) 등이 있다. 이로 인해 근육 내 근절, 세포골격의 파괴 등 골격근 내 구조적인 변형에 의한 손상이 일어나게 되고(Peake et al., 2017) 이후 근육 내 화학적 변화와 함께 일시적으로 근 기능의 감소가 나타나게 된다.
운동유발성 근육 손상 관련 연구들을 살펴보면 근생검(muscle biopsy)을 통해 직접적으로 관찰하는 방법도 있지만(Vincent et al., 2010) 인간을 대상으로 한 다수의 선행연구들은 관절 가동범위(ROM), 근력, 근육통증, 부종, 혈액 내 CK 활성 등의 간접적인 지표를 활용하여 진행되고 있는 것이 보편적이다(Chen et al., 2011; Clarkson et al., 1992; Hunter et al., 2012). 관련 선행연구에서는 운동유발성 근육 손상 후 나타나는 근 기능의 감소와 근육 손상 지표들의 변화를 관찰한 결과, 운동 전의 상태로 완전히 회복하는 데는 어느 정도의 기간이 소요되는 것으로 나타났으며(Clarkson et al., 1992) Nosaka & Clarkson(1996)은 신장성 운동 후 대상자별로 7일간 혈액지표의 변화를 관찰한 결과, 혈액지표의 수준이 최고치에 달하는 기간과 수준은 각각 다르게 나타났다. 이처럼 근육 손상의 정도나 회복 속도에는 개인별 차이가 존재하는 것으로 판단되며 나아가 유전적인 요소도 영향을 미칠 것으로 판단된다.
Baumer et al.(2016)의 연구보고에 따르면, 근육 손상과 관련된 유전자는 약 20여개로 밝혀져 있으며, 이 중 운동유발성 근육 손상 관련 연구에서 많이 활용되고 있으며 근육의 구조 및 기능과 밀접한 관련이 있는 유전자는 ACTN3이다(Baumert et al., 2016; Vincent et al., 2010). ACTN3 유전자 다형은 RR, RX, XX형이 존재한다. 인간의 골격근 내에서 발견되는 단백질은 α-actinin2와 α-actinin3이며(Seto et al., 2011) 그 중 type Ⅱ형 근섬유 내 Z-line의 구조적 기능에 중요한 역할을 하는 것은 α-actinin3 단백질이다(Norman et al., 2009). α-actinin3 단백질은 R-allele 형질에서 발견되고 X-allele의 경우 α-actinin3 단백질이 결핍된 형질로 알려져 있다(Baumert et al., 2016; MacArthur & North, 2004).
지금까지 ACTN3 유전자 연구는 운동선수의 운동수행력과 관련된 연구들이 대부분이지만(Cho et al., 2013; Kikuchi et al., 2016; Min et al., 2015; Yang et al., 2017), 근육 손상과 관련된 연구도 몇 편 보고되고 있다. Vincent et al.(2010)은 20대 남자 19명을 대상으로 RR형과 XX형을 비교한 결과 XX형에서 근육통증과 CK 활성이 높게 나타났다. 뿐만 아니라 트라이애슬론 선수들을 대상으로 진행한 연구에서는 철인 3종 경기(하프코스)를 실시하였을 때 레이스 종료 후 반동을 이용한 점프(countermovement jump)의 높이가 운동 시작 전보다 감소하였는데 이는 XX형에서 더 큰 감소율이 나타난 것으로 보고되었다(Del Coso et al., 2017). 반면 Clarkson et al.(2005)의 연구에서는 신장성 운동 후 knee extension torque를 측정하였을 때 ACTN3 유전자 다형 간에 유의한 차이가 나타나지 않았다. 또한 Venckunas et al.(2012)의 연구에서 20대 남성을 대상으로 낙하 후 점프(drop jump) 운동 후 14일간 근육 손상지표를 관찰한 결과, 운동 직후 최대 등척성 근력(MVC)에서 RR형이 XX형보다 더 큰 감소율이 나타났으며, CK의 경우 운동 후 48시간에 증가한 경향을 보였지만 RR형과 XX형 간에 유의한 차이는 없었다. 이상을 종합해보면, ACTN3 유전자와 근육 손상과 관련된 연구는 제한적이며 서로 상반되는 결과가 나타나기도 하였다. 더욱이, 아시아인을 대상으로 ACTN3 유전자 다형별 근육 손상지표의 차이를 검증한 연구는 아직 미흡한 실정이다.
따라서 본 연구는 신장성 운동 후 나타나는 근육 손상지표의 변화를 관찰하여 ACTN3 유전자 다형에 따른 회복의 차이가 있는지 검증하는 것에 목적이 있다.
연구방법
실험 절차
실험을 진행하기에 앞서 연구에 참여하는데 적합한 대상자들을 모집하기 위해 본 연구의 전체적인 절차와 연구 참여 중, 후 나타날 수 있는 증상에 관하여 충분하게 설명하였으며 참여 의사가 있는 대상자의 경우 연구 참여 동의서를 서면 작성한 후에 진행하였다. 참여 대상자는 연구 진행 기간 동안 웨이트 트레이닝을 포함한 고강도 운동과 불필요한 신체활동을 자제하도록 권고하였으며 약물 복용과 알코올 섭취를 금지하도록 하였다.
본 연구의 실험 진행 과정은 <Fig. 1>과 같다.
측정 항목 및 방법
신체조성
연구 참여 동의서 작성 후 신장성 운동을 실시하기 전, 자동 신장계와 체지방 분석기(Inbody 720, Inbody, Korea)를 이용하여 대상자들의 신장, 체중, 체지방률 등의 신체 조성을 측정하였다.
신장성 운동 프로토콜
본 연구에서는 팔꿈치 굽힘근(elbow flexor)에 신장성 수축을 발생시키기 위해 Kim et al.(2012)의 연구에서 사용한 것과 동일한 변형된 프리쳐 컬 기구를 활용하여 신장성 운동을 실시하였다.
운동 방법은 대상자가 버티는 컬(curl) 동작을 수행할 때 실험보조자는 프리쳐 컬에 설치된 바(bar)를 잡고 누르는 동작을 실시하여 대상자의 팔꿈치 굽힘근에 최대 신장성 수축력이 발생하도록 하였다. 적용된 신장성 운동 프로토콜은 Clarkson et al.(1992)의 연구에 따라 25회/1set(총 2set), set 간 휴식 시간(5분)을 설정하였고 1회 실시 시 최대 근력을 발휘하여 3초간 버티는 동작을 수행하게 하였으며 회당 사이에 휴식 시간(12초)을 제공하였다.
최대 근력
최대 근력(maximal isometric contraction, MIC) 측정은 Lee & Clarkson(2003)의 연구를 참고하여 신장성 운동을 실시한 프리쳐 컬 기구에 근력측정기(Jackson strength evaluation system 32628CTL, Lafayette Instruments, USA)를 연결하여 측정하였다. 연구 대상자는 신장성 운동을 수행할 때와 동일한 준비 자세를 취한 상태에서 팔꿉관절각이 직각상태가 되도록 만들어준 다음 3초간 최대 힘을 발휘하여 당기는 동작을 수행하였다. 최대 근력의 측정 시기는 운동 전과 직후, 운동 후 24, 48, 72, 96시간에 측정하였고 각 측정 시기마다 2회씩 실시하여 평균 peak값을 산출하였다.
근육통증
근육통증(muscle soreness, SOR)은 운동유발성 근육 손상 시 근육통증을 측정하는 도구로 활용되고 있는 시각통증척도(visual analogue scale, VAS)를 사용하였으며 운동 전, 운동 후 24, 48, 72, 96시간에 측정하였다.
혈액 지표(CK) 분석
혈액 지표(CK) 분석을 위해 8시간 이상 공복 상태를 유지한 후 상완 정맥에서 1회에 3ml씩 채혈하였으며 채혈한 혈액은 진공 채혈관(SST™Ⅱ advance plus blood collection tube 5ml, Becton Dickinson, USA)에 주입한 다음 원심분리기를 이용하여 3000rpm으로 10분간 원심 분리하였다. 원심 분리 후 분리된 혈장은 microtube(1.5ml)에 담은 후 분석 전까지 -80℃에 냉동 보관하였다. 분석을 실시하기 전, 혈장을 상온에서 녹인 후 CK assay kit(AceChem CK kit, 영동제약㈜, Korea)와 생화학 분석기(Miura one, I.S.E. S.r.l., Italy)를 이용하여 분석하였다. 채혈 시기는 운동 전, 운동 후 24, 48, 72, 96시간에 실시하였다.
ACTN3 유전자 다형 분석
DNA 추출
DNA는 피험자의 구강상피세포에서 추출하였다. 추출 전 구강 내 이물질 제거를 위해 입안을 헹군 다음 일회용 살균면봉(Single Warpped, COPAN, CA, USA)을 이용하여 15초정도 회전시켜 구강상피세포를 채취하였다. 채취한 상피세포는 DNA lysis solution 400㎕가 담긴 micro tube(1.5ml)에 침전시키고 95℃에서 3분간 인큐베이션(incubation)을 실시하였다. 이후 DNA stabilizing solution을 400㎕ 첨가하고 실험 실시 전까지 4℃에 냉장 보관하였다.
Polymerase Chain Reaction(PCR) 및 ACTN3 genotyping
PCR은 TaqMan Probe법을 이용하여 분석하였으며 TaqMan GTXpress Master Mix, TaqMan genotyping assay mix(rs 1815739, Pre-Designed SNP Genotyping assays, Applide Biosystems, USA)와 DNase-free water를 각각 혼합한 후 DNA 1.5㎕를 첨가하여 최종 볼륨 10㎕에 맞추었다. DNA 증폭은 Thermal Cycler(7500, Applied Biosystem, USA)을 사용하였으며 <Table 1>과 같은 조건으로 실시하였다.
Table 1.
Thermal-cycling conditions
| Stage | Step | Temperature | Time |
|---|---|---|---|
| Holding |
DNA Polymerase activation |
95℃ | 20 sec |
|
Cycling (40 cycles) |
Denature | 95℃ | 15 sec |
| Anneal/extend | 60℃ | 60 sec |
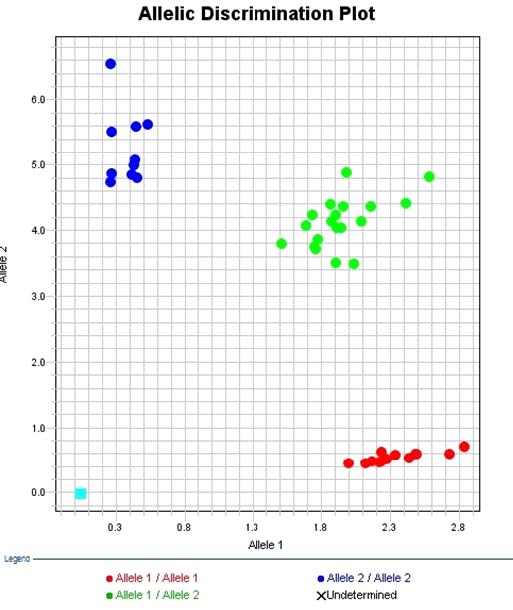
ACTN3 유전자 다형 판별은 분석프로그램(7500 Software Ver23, Applied Biosystem, USA)을 이용하였으며, PCR을 실시할 때 실험적 오류를 최소화하기 위해 항상 Negative Control(DNA 미첨가물)과 Positive Control(이미 분석된 DNA: RR/RX/XX)을 각각 첨가하여 분석을 실시하였다<Fig. 2>.
자료 분석
본 연구에서 통계 처리는 Window용 SPSS/PC Ver 23.0 통계 프로그램을 이용하였으며 모든 측정값의 평균 및 표준편차를 산출하였다. 이후 ACTN3 유전자 다형성의 분포를 확인하기 위해 Hardy-Weinberg equilibrium(HWE) 평형성 검증을 실시하였다.
ACTN3 R577X 유전자 다형에 따라 최대 근력, 근육통증, CK 등 각 변인들의 시기별 변화를 알아보기 위해 반복측정 이원분산분석(two-way repeated measure ANOVA)을 실시하였으며, 사후검정은 Bonferroni 방법을 사용하였다. 모든 자료의 통계적 유의수준은 α<.05로 설정하였다.
연구결과
ACTN3유전자 다형의 분포 및 신체조성
연구 대상자들의 ACTN3 유전자 다형성의 분포를 확인하기 위해 Hardy-Weinberg equilibrium(HWE) 평형성 검증을 실시한 결과, HWE분류는 p=0.98(x²=0.000652, df=1.0)로 나타나 평형성이 검증되었다. ACTN3 유전자 다형의 비율은 각각 RR형 22%(11명), RX형 50%(25명), XX형 28%(14명)으로 나타났다<Table 2>.
ACTN3 유전자 다형별 신체조성은 <Table 3>과 같다. RR homozygote 집단과 X-allele 집단 간의 신체조성을 비교한 결과 유의한 차이는 나타나지 않았으며(p>.05) ACTN3 유전자 다형간의 신체조성[Age: 21.9±2.7(RX), 23.4±3.0(XX); Height(cm): 175.6±5.7(RX), 175.6±6.5(XX); Weight(kg): 69.5±9.3(RX), 77.5±10.0(XX); Fat(%): 16.4±5.8(RX), 17.2±4.9(XX)]에서도 통계적으로 유의한 차이는 없었다(p>.05).
ACTN3 유전자 다형별 혈중 CK 활성의 변화
ACTN3 유전자 다형별 혈중 CK 활성의 결과는 다음과 같다<Table 4>. 혈중 CK 활성에서는 집단 간 유의한 차이가 없었으며(p=.243) ACTN3 유전자 다형과 혈중 CK 활성 간의 상호작용 또한 나타나지 않았다(p=.357). 그러나 각 시기별 혈중 CK 활성을 운동 전(Pre)과 비교하였을 때 모든 시기에서 유의한 차이가 나타났으며(p<.05) 운동 후 96h에 가장 높게 나타났다.
ACTN3 유전자 다형별 근육통증(SOR)의 변화
ACTN3 유전자 다형별 근육통증의 측정 결과는 다음과 같다(Fig. 3). 근육통증은 집단 간 유의한 차이가 나타났으며(p=.033) 근육통증과 집단 간의 상호작용도 나타났다(p=.047). 각 시기별 근육통증의 변화량을 보면, 운동 전과 비교하였을 때 모든 시기에서 유의한 차이가 나타났으며(p<.001) 운동 후 24h과 48h에 크게 증가하였다. 운동 후 24h에서 집단 간 유의한 차이가 있는 것으로 나타났으며 X-allele 집단이 RR homozygote 집단보다 근육통증이 더 높은 것으로 관찰되었다(p<.05). 또한 통증이 가장 높게 나타난 시기(운동 후 48h)와 96h 시기를 비교한 결과, 두 집단 모두 유의한 차이가 있는 것으로 나타났다(p<.05).
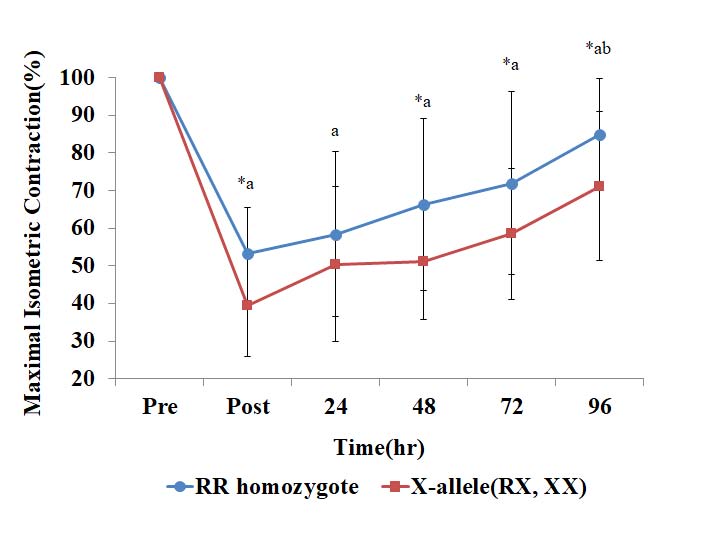
ACTN3 유전자 다형별 최대 근력(MIC)의 변화
본 연구에서 ACTN3 유전자 다형(RR homozygote, X-allele)에 따른 최대 근력의 측정 결과는 <Fig. 4>와 같다. 최대 근력은 집단 간 유의한 차이가 나타났으며(p=.015) 최대 근력과 집단 간의 상호작용도 나타났다(p=.048). 각 시기별 최대 근력의 변화량을 운동 전(Pre)과 비교하였을 때 모든 시기에서 유의한 차이를 보였고(p<.001) 두 집단 모두 운동 직후(post)에 가장 큰 감소율이 나타났다. 이 시기에 집단 간 최대 근력의 차이는 유의한 것으로 나타났으며 X-allele 집단이 RR homozygote 집단보다 더 크게 감소한 것으로 나타났다(p<.05). 또한 운동 직후(post)와 운동 후 96h 시기를 비교하였을 시 최대 근력의 변화량은 유의한 것으로 나타났으며(p<.05) RR homozygote 집단이 X-allele 집단보다 유의하게 높은 것으로 나타났다(p<.05).
논 의
본 연구는 신장성 운동 후 ACTN3 유전자 다형(RR homozygote, X-allele)에 따라 최대 근력, 근육통증, 혈중 CK 활성 등의 근육 손상지표의 차이를 검증하는 것을 목적으로 실시하였다. 그 결과, 최대 근력의 감소율과 근육통증에서는 RR homozygote 집단이 X-allele(RX+XX)집단보다 유의하게 낮은 것으로 나타났다. 또한, 혈중 CK 활성에서는 집단 간 유의한 차이는 없었지만 X-allele(RX+XX) 집단이 RR집단보다 높게 나타나는 경향을 보였다.
최대 근력은 운동 직후에 가장 크게 감소하는데 본 연구 결과에서 집단별 운동 직후 최대 근력의 감소율은 RR homozygote: -46.8%, X-allele: -60.5%로 <Fig. 4>에서 확인할 수 있으며 선행연구와 비슷한 경향을 보였다(Clarkson et al., 2005). 또한 운동 후 일정기간 동안 반복 측정하면서 최대 근력의 회복 과정을 관찰한 결과 본 연구에서 측정된 결과와 유사하게 나타났다. 본 연구에서는 RR homozygote 집단이 X-allele (RX+XX)집단 보다 운동 직후 최대 근력 감소율이 더 적게 나타났으며 운동 후 관찰기간 동안 운동 전의 상태로 되돌아오는 회복 또한 빠른 것으로 나타났다. 일반적으로 신장성 운동 후 Z-line streaming과 같은 근육 내부의 구조 변형이 일어나게 되면서(Clarkson & Hubal, 2002) 근력 감소와 같은 기능적 손실을 유발하게 된다(Bridgeman et al., 2017). 더욱이, Vincent et al.(2007)은 일반인 10~20대 남성을 대상으로 ACTN3 유전자 다형에 따른 근섬유 type의 분포를 알아보았는데 typeⅡx 근섬유의 비율은 RR형이 XX형에 비해 유의하게 높은 것으로 나타났으며, isokinetic dynamometer를 활용한 knee extensor 운동 후 근파워 측정 시 dynamic quadriceps torque 300°/s에서 유의하게 높은 것으로 나타났다. 이러한 선행연구를 근거로 α-actinin3를 가지고 있는 typeⅡ 근섬유의 비율이 높은 것으로 알려진 RR형에서 최대 근력의 감소율이 낮게 나타난 본 연구의 결과에 대한 근거로 제시할 수 있을 것으로 판단된다.
근 손상으로 인해 나타나는 DOMS는 운동 후 24~72시간 사이에 최고치에 이른다고 보고되고 있는데(Cheung et al., 2003; Connolly et al., 2003) 이는 본 연구에서도 두 집단 모두 운동 후 24~72시간 사이에 최대치가 나타난 것으로 관찰되었다(Fig. 3). Vincent et al.(2010)의 연구에서는 최대 신장성 knee extension 운동을 실시한 후 VAS score를 이용하여 근육통증을 측정한 결과, 운동 후 24, 48시간에서 XX형 집단이 RR형 집단보다 유의하게 높게 유지된 것으로 보고되었다. 이는 본 연구에서 X-allele 집단이 RR homozygote 집단보다 높게 유지된 결과와 일치하는 것으로 나타났다. 또한 DOMS는 관절의 가동범위나 근 기능 감소 등을 수반하여 신체활동에 악영향을 미치기도 하는데(Cheung et al., 2003; Kargarfard et al., 2016) 본 연구에서 X-allele 집단이 RR homozygote 집단보다 근육통증이 높게 유지되면서 근력 회복이 다소 더딘 경향이 나타난 것으로 보아 근육 및 결합조직의 손상으로 인해(Cheung et al., 2003) 영향을 받았을 것으로 판단되며 결과적으로 근 손상에 취약한 X-allele 집단에서 느린 회복의 결과가 나타난 것으로 사료된다.
혈중 CK 활성은 대개 고강도 신장성 운동 후에 증가하게 되며(Clarkson, Nosaka & Braun, 1992) 운동 후 24~96시간 사이에 가장 높게 나타난다(Brancaccio et al., 2007; Koch et al., 2014). Sayers & Clarkson(2003)의 연구에서는 팔꿈치 굴근을 대상으로 신장성 운동을 실시한 후 처치 집단과 비처치 집단을 비교한 결과, 비처치 집단에서 혈중 CK 활성이 크게 증가하였으며 운동 후 96시간에 가장 높게 나타났다. 또한 Lee & Park(2011)의 연구에서도 등속성 운동 기구를 활용하여 팔꿈치 굴근의 신장성 운동을 실시한 결과, 운동 후 24시간부터 유의하게 증가하여 운동 후 96시간에 최고치에 도달한 것으로 나타났다. 본 연구의 결과에서도 앞서 제시한 선행연구와 같이 혈중 CK 활성의 변화 추세가 유사하게 나타나는 경향을 보였다<Table 4>.
ACTN3 유전자 다형별 CK 활성의 변화를 비교한 선행연구에서는 XX형이 높은 것으로 나타났다(Pimenta et al., 2012; Vincent et al., 2010). Del Coso et al.(2017)의 연구 결과에서는 X-allele(RX+XX)집단이 RR homozygote 집단보다 혈중 CK 활성이 높은 것으로 본 연구의 결과와 일치하는 것으로 나타났지만, 다른 연구에서는 집단 간 유의한 차이가 나타나지 않았거나 상반된 결과가 도출되기도 하였다(Venckunas et al., 2012). 이는 CK 활성이 증가되는 시기와 크기는 개별요인과 운동의 종류에 따라 다르게 나타나고(Koch et al., 2014) 가변성이 큰 특징을 가지고 있기 때문인 것으로 판단된다. 또한 고강도 운동 후 ACTN3 유전자 다형에 따른 근 손상지표의 변화를 관찰한 연구에서는 XX형은 R-allele 보다 민감하게 반응하는 것으로 보고되었다(Pimenta et al., 2012). 이는 X-allele(RX+XX)가 RR형에 비해 α-actinin3 단백질이 다소 적게 있거나 결핍되어있는 특징 때문에 영향을 미쳤을 것으로 사료되며 극심한 운동 후 나타나는 근 손상으로 인해 발생할 수 있는 횡문근융해증(Furman, 2015; Lee, 2014)을 경험할 위험성 또한 XX형에서 더 높을 것으로 판단된다.
다만, 본 연구는 지금까지 진행된 ACTN3 유전자 다형별 근력 및 근육 손상지표 관련 연구의 표본 수에 비해 다소 적은 표본 수로 진행하였기 때문에 본 연구에서 나타난 결과를 좀 더 일반화시키기 위해서는 대상자 수를 늘리는 것과 동시에, ACTN3 유전자 이외에 근 기능과 관련된 또 다른 유전자형을 복수로 분석하여 근 손상에 영향을 주는 요인들에 대한 다각적인 접근이 필요할 것이다.
결론 및 제언
본 연구는 일반인 20대 남성을 대상으로 팔꿈치 굴근의 신장성 운동을 수행한 후 ACTN3 유전자 다형별 최대 근력, 근 통증 및 CK 활성의 차이를 검증하는 것을 목적으로 실시한 결과, 다음과 같은 결론을 얻었다.
1) ACTN3 RR homozygote 집단이 X-allele(RX형, XX형)집단보다 최대 근력의 감소율과 근 통증이 유의하게 낮게 나타났다.
2) ACTN3 RR homozygote 집단이 X-allele(RX형, XX형)집단보다 혈중 CK 활성이 낮은 경향을 보였다.
이러한 결과들을 종합해보면, 일반인들이 고강도 운동 후 겪게 되는 근 손상으로 인해 추가적으로 나타나는 근육통증, 컨디션의 악화 등으로부터의 회복을 위해 ACTN3 유전자 다형별로 나타나는 특징을 바탕으로 운동프로그램을 개발하고 적용하는데 유용하게 활용할 수 있을 것으로 보인다. 예를 들어, ACTN3 X-allele를 보유한 사람들은 트레이닝 시 강도를 낮추고 횟수를 증가시키는 등의 운동량 조절을 통해서 근 손상을 최소화 시킬 수 있다.





 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print