8주간의 저항성 운동과 크레아틴, 류신의 투여가 흰쥐의 근 단백질 합성 및 골격근 특성에 미치는 영향
The Effect of Dietary Creatine and Leucine Supplementation on Protein Synthesis and Functional Properties of Skeletal Muscle During 8 Weeks of Resistance Exercise
Article information
Abstract
이 연구에서는 8주간의 저항성 운동 시 크레아틴, 류신의 투여가 근 단백질 합성과 근비대에 어떠한 영향을 미치는지 규명하는데 그 목적이 있다. 실험동물은 SD계 흰쥐 수컷 32마리를 사용하였으며, 대조군(CON), 운동군(E), 운동과 크레아틴 투여군(EC), 운동과 크레아틴, 류신 투여군(ECL)으로 분류하였다. 저항성 운동은 점진적으로 증가시킨 중량을 꼬리에 연결하여 사다리를 오르는 방법을 이용하였으며(주 3회), 보조제 투여는 크레아틴은 250㎎/kg, 크레아틴+류신은 250+250㎎/kg의 양을 매일 구강 투여하였다. 실험 결과, 체중은 모든 집단에서 실험 초기에 비해 유의하게 증가하였고(p<.001), CON군의 체중이 저항성 운동을 실시한 세 집단의 체중보다 유의하게 많이 나갔다(p<.05). plantaris 무게는 E군이 CON군에 비해 유의하게 증가하였으며(p<.05), FHL 근육무게는 운동을 실시한 세 집단이 CON군에 비해 유의하게 증가하였다(p<.05). 또한 E군이 EC군, ECL군보다 유의하게 증가하였다(p<.05). 최대근력은 저항성 운동을 실시한 세 집단 모두 실험 초기에 비해 유의하게 증가하였으며(p<.001), 집단 간 차이는 없었다. Phospho-Akt 발현은 보조제를 투여한 EC군과 ECL군이 유의하게 감소하였으며(p<.05), Phospho-mTOR는 유의한 차이가 없이 증가하는 경향을 보였다. 따라서 저항성 운동은 근육량의 증가와 근력 향상에 긍정적인 영향을 미치지만, 추가적으로 처치한 크레아틴과 류신의 영향은 미비한 것으로 판단된다. 그러나 세포내 수준에서 phospho-mTOR 단백질 발현이 증가하는 경향을 보임으로써 그 가능성을 확인할 수 있었고, 추후에는 단백질 합성에 관여하는 다양한 요인들을 세밀하게 관찰하는 연구가 필요할 것으로 사료된다.
Trans Abstract
The purpose of this study was to examine the effect of dietary creatine and leucine supplementation on protein synthesis and functional properties of skeletal muscle during 8 weeks of resistance exercise. Thirty two male Sprague-Dawley rat(5 weeks old) were randomly divided into four groups(8 rats per group): sedentary control group(CON), execise group(E), exercise with creatine supplementation group(EC), exercise with creatine, leucine supplementation group(ECL). Exercise groups were trained to climb a ladder with a weight secured to their tails(3day/week). The supplementation was administrated daily through oral gavage. Creatine supplementation was given at 250㎎/㎏/day. Creatine+leucine supplementation was given at 250+250㎎/㎏/day. All exercise groups presented significantly lower epididymal fat mass than CON(p<.05). E presented significantly higher plantaris mass than CON(p<.05). All exercise groups significantly presented higher FHL mass than CON(p<.05) and E presented higher FHL mass than EC, ECL(p<.05). EC, ECL presented significantly lower expression of Akt/PKB protein than CON, E(p<.05). There was no difference in the expression of mTOR protein. The results suggest that the creatine and leucine supplementation does not promote any additional hypertrophic effect on resistance trained skeletal muscle. But, creatine and leucine supplementation might have a potential benefit on skeletal muscle hypertrophy through the activation of protein synthesis.
서 론
인체에는 수백 개의 골격근이 존재하며, 체중의 약 45%를 차지하는 가장 큰 신체구성 요소로서 움직임을 만들고 자세를 유지하는 역할을 한다. 비사용, 상해, 운동중단, 노화에 의해 발생하는 근육량의 감소와 근 기능의 감소는 신체적 건강은 물론 일상생활에도 제한을 주기 때문에 삶의 질까지 떨어뜨리게 된다. Kell et al.(2001)은 근육량을 증가시키고 근 기능을 향상시킬 경우 관상동맥 혈관질환 위험요소가 감소되고, 골밀도 증가를 통해 골다공증 발생률이 감소된다고 보고하였다. 또한 노화에 따른 일상생활 수행능력의 감소와 낙상, 골절 등을 예방할 수 있고, 나아가 상해, 장애, 사망과 밀접한 관련을 갖는다고 보고하였다. 따라서 다양한 질병을 예방하고 보다 나은 삶을 위하여 지속적으로 근육량 유지 및 증진시키기 위한 노력이 필요하며, 보다 효과적인 방법을 모색하기 위한 다각적인 연구가 필요하다.
골격근은 다양한 자극에 적응력이 뛰어난 조직으로 영양이나 기계적 부하에 빠르게 반응하여 골격근을 성장시킨다(Egan & Zierath, 2013; Schoenfeld, 2010; 권영섭과 소호성, 2007). 그 중 저항성 운동은 골격근의 상해를 유발하고, 항상성을 위한 면역반응 물질들을 증가시키는 것으로 알려져 있으며, 또한 세포 내외의 신호전달 물질들을 증가시키고, 단백질 합성을 위한 phosphoinositide 3 kinase(PI3K)-protein kinase B(PKB/Akt)-mammalian target of rapamycin(mTOR) 신호전달 경로를 촉진시키는 것으로 보고되고 있다(Miyazaki & Esser, 2009; Bodine, 2006; Glass, 2003). mTOR는 세포의 성장, 증식, 이동과 생존은 물론, 단백질 합성을 조절하는데 중요한 역할을 하며, 골격근에서는 근육세포의 분화와 융합을 조절하고, 새로운 근섬유를 형성하고 근육의 크기를 증가시켜 근 기능을 향상시킨다(Ge & Chen, 2012; Wullschleger et al., 2006; Hay & Sonenberg, 2004). 흰쥐를 대상으로 8주간의 사다리 타기 유형의 저항성 운동을 실시한 Hornberger & Farrar(2004)의 연구에서는 flexor hallucis longus(FHL) 근육의 무게가 37% 증가하였다고 보고되고 있다.
또한 영양학적 보조 방법을 통해서도 근육량 증가와 근력향상에 긍정적인 영향을 미칠 수 있다. 선행 연구들에 의하면 여러 영양 보조제 중 크레아틴(creatine)이 근육량의 증가와 근력 향상에 효과가 있는 것으로 보고되고 있다(Cooper et al., 2012; Kreider, 2003). 크레아틴은 주로 간과 신장에서 3개의 아미노산인 글리신, 아르기닌, 메티오닌으로부터 합성되거나, 육류와 생선과 같은 식품을 섭취함으로써 얻을 수 있는 아미노산 유사물질로써 골격근 줄기세포인 위성세포를 활성화 시키고, myogenic factor 5(Myf5), myogenic differentiation 1(MyoD), myogenin, myogenic factor 6(Myf6)와 같은 다양한 myogenic regulatory factor들과 함께 발현하여 새로운 근섬유를 만들거나 손상을 입은 근육 재생에 기여하는 것으로 보고되고 있으며(Olsen et al., 2006; Willoughby & Rosene, 2003), insulin like growth factor 1(IGF-1)이나 인슐린, 성장호르몬, 테스토스테론과 같은 신호전달 물질을 증가시켜 PI3K-Akt-mTOR 경로를 활성화시키는 것으로 보고되고 있다(Burke et al., 2008; Deldicque et al., 2007; Deldicque et al., 2005).
또 다른 보조제 중 하나인 류신(leucine)은 단백질을 구성하는 아미노산의 일종으로써 이소류신(isoleucine), 발린(valine)과 함께 분지사슬아미노산(branched chain amino acids; BCAA) 형태로 체내에 가장 많이 저장되어 있다. 류신은 식이 아미노산 중 유일하게 mTOR 신호전달 경로를 자극하고, 근단백질 합성의 증가와 근단백질 분해를 감소시켜 근육량 증가에 긍정적인 효과를 미치는 것으로 알려져 있다(Jewell et al., 2013; Pasiakos, 2012; Meijer & Dubbelhuis, 2004).
전술한 바와 같이 저항성 운동, 크레아틴, 류신의 단일처치는 근육량 증가를 위한 세포 내·외의 여러 신호전달 물질들을 증가시키고, mTOR를 통해 근 단백질 합성을 증가시키는 것으로 보고되고 있다. 하지만 아직까지 서로 다른 형태의 자극인 운동과 보조제를 복합처치 했을 시 mTOR가 어떻게 작용하는지에 대한 기전은 불분명하며, 또한 근육량 증가에 어떠한 영향을 미치는지도 아직 불분명하다. 따라서 본 연구에서는 저항성 운동과 크레아틴, 류신을 복합처치하여 근육량, 최대근력, 단백질 합성 인자인 phospho-Akt와 phospho-mTOR를 관찰하여 복합처치에 따른 additive effect 또는 synergistic effect를 갖는지를 규명하고자 한다.
연구방법
실험동물
실험동물은 수컷 Sprague-Dawley(SD)계 흰쥐 32마리를 사용하였으며, 대조군(CON; n=8), 운동군(E; n=8), 운동+크레아틴 투여군(EC; n=8), 운동+크레아틴+류신 투여군(ECL; n=8)으로 분류하였다. 10일간의 실험환경에 대한 적응기를 거친 후, 실험동물이 5주령이 되었을 때 본 실험을 실시하였다. 실험동물 관리는 각 그룹 당 2~3마리씩 하나의 cage에 넣어 사육하였으며, 온도 22~24℃, 습도 50~60%, 조명 12/12시간; light-dark cycle을 유지하였고, 사료는 단백질 20%, 지방 4.5%, 섬유 6%, 회분 7%, 칼슘 0.5%, 인 1%로 조성된 사료를 공급하였다(퓨리나, Korea). 식이 및 수분섭취량은 ad libitum으로 하였다.
운동 방법
저항성 운동은 Hornberger & Farrar(2004)의 연구를 참고하였고, 운동부하를 점증적으로 증가시켜 사다리(높이 1m, 기울기 80˚)를 오르게 하였다. 적응훈련은 운동부하 없이 10일간 실시하였고, 본 훈련은 주 3회, 총 8주 동안 실시하였다. 실험동물 꼬리에 conical tube을 연결한 다음, 동전을 이용하여 운동 부하를 매회 점증적으로 증가시켰다. 이전에 실시한 운동 종료시점의 무게를 최대근력 1RM(one repetition maximum)으로 설정하였고, 1RM의 50%강도로 1회, 75%로 1회, 90%로 1회, 100%로 1회, 그 이후에는 30g씩 추가하여 실시하였다. 실험 2주차까지는 훈련 적응을 위하여 운동 횟수가 10회 미만이더라도 1RM에서 훈련을 종료하였으며, 8주차까지는 총 운동량을 맞추기 위해 훈련을 1RM까지 실시한 후, 운동 부하를 낮춰 운동 횟수가 총 10회가 되도록 설정하였다.
보조제 투여
크레아틴과 류신은 국내 P사로부터 공급받아 사용하였으며, 보조제를 물에 섞어 경구용 튜브를 이용하여 매일 구강 투여하였다. 보조제는 Gagnon et al.(2002)와 Pasiakos & McClung(2011)의 연구를 참고하여 일반적으로 알려진 SD 흰쥐의 식이 패턴에 따라 투여하였다. EC군은 크레아틴 250㎎/㎏ body weigh의 양을, ECL군은 크레아틴 250㎎+류신250㎎/㎏ body weight의 양을 투여하였다. 투여 시기는 운동 후 45분 이내로 하였으며, 운동을 실시하지 않은 날에도 투여는 동일한 시간대에 실시하였다. 보조제를 투여하지 않은 CON군과 E군도 같은 시간에 물로 구강 투여하였다.
실험동물 해부와 조직 샘플 적출
모든 실험동물은 마지막 운동 48시간 후, 마지막 크레아틴과 류신 투여 24시간 후, 12시간동안 절식시킨 다음 guillotine을 이용하여 단두사살 하였다. 근육은 왼쪽 다리에서 soleus, plantaris, flexor hallucis longus(FHL), extensor digitorum longus(EDL)을 적출하였다. 적출 즉시 무게를 측정하고 액체질소로 급속 냉동시킨 후 분석 시까지 –70℃에서 보관하였다.
단백질 추출 및 정량
단백질을 추출하기 위하여 근비대가 가장 많이 나타난 FHL 근육을 집단별로 10㎎씩 총 80㎎을 준비한 뒤, lysis buffer(#17081, Intron Biotechnology, Korea) 2.4㎖을 첨가하여 homogenizer로 근육 조직을 분쇄하였다. 그 다음 4℃에서 13,000 rpm으로 5분간 원심 분리한 후 상층액을 Bradford 방법(1976)에 따라 총 단백질량을 정량하였다. 단백질 발현을 보다 명확하게 확인하기 위하여 면역침강법을 실시하였다. 단백질 2㎎을 준비한 후, 1차 항체인 phospho-Akt (Ser473)(#9271, Cell Signaling, USA)와 phospho-mTOR(Ser2448) (#2971, Cell Signaling, USA)를 1:100 (20μl)으로 희석하여 4℃에서 overnight 동안 반응시켰다. 그 다음 Protein G PLUS-Agarose(Santa Cruz Biotechnology, USA)를 40㎕ 넣고 4℃에서 다시 overnight동안 반응시켰고, 그 다음 4℃에서 2,500 rpm으로 5분간 원심분리 한 후, 얻어진 pellet을 1X PBS 용액으로 4회 세척하여 샘플을 획득하였다.
Western blot
단백질은 10% SDS-polyacrylamide gel에서 80V에서 90분 동안 전기영동을 하고 15V에서 60분 동안 membrane으로 전이시켰다. 5% skim milk가 첨가된 용액으로 60분 동안 상온에서 blocking 하였다. 그 다음 3% skim milk에 1:500으로 희석된 1차 항체 phospho-Akt (Ser473)(#9271, Cell Signaling, USA)와 phospho-mTOR(Ser2448)(#2971, Cell Signaling, USA) 용액을 첨가하여 4℃에서 overnight 동안 반응시켰다. 1차 항체를 반응 시킨 후 3% skim milk에 1:1000으로 희석시킨 2차 항체 horseradish peroxidase-conjugated goat anti-rabbit IgG(#7074, Cell Signaling, USA)를 상온에서 60분 동안 반응시켰다. ECL solution (WSE-7120S, ATTO, Japan)으로 발색하여 ImageMaster™ 2D Elite software, version 3.1(Amersham Pharmacia Biotechnology, UK)으로 단백질 발현을 확인하였다.
자료 처리 및 통계
이 연구 결과 얻어진 자료를 SAS 9.2 통계 프로그램을 사용하여 하위집단별 기술 통계치(mean, SD)를 산출하였다. 체중과 최대근력은 집단(4)×기간(8) 반복측정에 의한 이원변량분석(repeated two-way ANOVA)을 실시하였으며 상호작용효과가 있을 경우 그 차이를 구체적으로 확인하기 위하여 집단 간 차이는 Tukey, 시기 간 차이는 contrast을 이용하여 사후검증을 실시하였다. 집단 간 근육의 무게, phospho-Akt, phospho-mTOR 단백질 발현에 대한 차이를 분석하기 위해 일원변량분석(one-way ANOVA)을 적용하였고, 분석 결과 통계적으로 유의한 차이가 나타날 경우 Tukey을 이용하여 사후검증을 실시하였다. 가설의 수락 기준은 α=.05로 설정하였다.
연구결과
체중 및 근육의 무게
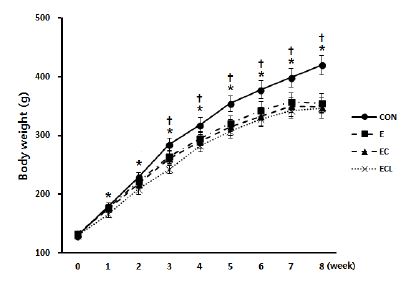
실험동물의 체중은 매주 1회, 동일한 시간대에 측정하였다. <그림 1>에 제시한 바와 같이 모든 집단은 실험초기에 비해 체중이 유의하게 증가하였다(p<.001). 실험 3주차까지는 유의한 차이 없이 비슷한 체중 증가를 보였으나, 3주차부터는 ECL군이 CON군에 비해 유의하게 낮은 체중 증가를 보였으며(p<.05), 5주차부터는 EC군과 ECL군이 CON군에 비해 유의하게 낮은 체중 증가를 보였다(p<.05). 8주차에는 저항성 운동을 실시한 E군, EC군, ECL군이 CON군에 비해 유의하게 낮은 체중 증가를 보였다(p<.05). 저항성 운동을 실시한 E군, EC군, ECL군 간의 유의한 차이는 없었다. soleus와 EDL의 무게는 집단 간 유의한 차이가 없었으며, plantaris 무게는 E군이 CON군보다 유의하게 높게 나타났다(p<.05). FHL 무게는 저항성 운동을 실시한 세 집단이 CON군보다 유의하게 높게 나타났으며(p<.05), 운동을 실시한 집단 내에서는 E군이 EC, ECL군 보다 유의하게 높게 나타났다(p<.05).
최대근력
저항성 운동을 실시한 세 집단은 실험 초기에 비해 최대근력 1RM이 유의하게 증가하였으며(p<.001), 집단 간 유의한 차이는 없었다(그림 2).
논 의
본 연구에서는 수컷 SD계 흰쥐를 대상으로 저항성 운동을 실시한 후 다른 영양 보조제를 추가 처치함으로써 근 단백질 합성에 어떠한 영향을 미치는지, 근육의 무게와 최대근력에는 어떠한 영향을 미치는지를 알아보고자 실시하였다.
총 8주간의 실험기간 동안 모든 실험동물은 실험초기에 비해 체중이 유의하게 증가 하였으며, CON군이 운동을 실시한 세 집단보다 더 큰 체중 증가를 보였다(표 1). 모든 실험동물의 유의한 체중 증가는 실험 시작 당시 5주령이었던 실험동물의 성장 결과로 보이며, CON군에 비해 저항성 운동을 실시 한 세 집단에서 체중이 적었던 것은 저항성 운동으로 인해 신체활동량이 늘었기 때문으로 사료된다. Franco et al.(2011)은 흰쥐를 대상으로 수직 점프 형태의 저항성 운동을 6주 처치한 결과, 저항성 운동을 실시한 집단이 대조군보다 낮은 체중증가를 본 연구 결과와 비슷한 체중감소 효과를 보였다. 또한 본 연구에서는 저항성 운동만을 실시한 집단과 보조제를 추가적으로 처치한 집단 간의 유의한 차이는 나타나지 않았다. 이는 흰쥐를 대상으로 운동과 보조제를 복합처치한 Aguiar et al.(2010)과 de Campos-Ferraz et al.(2011)의 연구와 일치하는 결과로서 저항성 운동은 체중의 변화에 영향을 미치지만, 추가적으로 처치한 보조제는 체중 변화에 어떠한 영향도 미치지 않은 것으로 사료된다.
저항성 운동은 근원섬유 단백질 합성의 증가, 근섬유 크기의 증가, 근 비대 등 골격근의 형태학적 변화를 야기하고, 근력의 증가를 통해 무산소성 운동 수행능력을 향상시키는 것으로 보고되고 있다(Egan & Zierath, 2013; Hornberger & Farrar, 2004; Baar & Esser, 1999). 본 연구에서 나타난 plantaris와 FHL 무게의 유의한 증가 역시, 8주간의 저항성 운동에 영향을 받아 근비대가 나타난 것으로 사료된다. 그러나 근비대 역시 저항성 운동에 대한 영향만 나타났을 뿐, 추가적으로 처치한 보조제의 영향은 없었으며, 오히려 근육의 무게가 감소하는 경향을 나타냈다.
지금까지 이루어진 보조제에 대한 선행연구들을 살펴보면, Nissen & Sharp(2003)의 메타분석에서는 여러 보조제 중 크레아틴과 류신의 대사산물인 β-Hydroxy-β-methylbutyrate(HMβ)가 제지방량의 증가와 근력 향상에 긍정적인 영향을 미치는 것으로 보고되고 있다. Young & Young(2007)는 흰쥐에게 운동 자극 없이 크레아틴만을 5주 처치한 결과, 근육량이 유의하게 증가하였고, Jówko et al.(2001)의 연구에서도 20대 성인 남성을 대상으로 크레아틴과 HMβ를 3주 동안 복합처치한 결과, 크레아틴 섭취 집단과 HMβ 섭취 집단의 제지방량이 대조군의 제지방량보다 유의하게 증가하였으며, 특히 크레아틴과 HMβ를 복합처치한 집단에서 보조제를 각각 섭취 했을 때보다 더 큰 제지방량 증가를 보임으로써 보조제의 섭취가 근육량 증가에 긍정적인 영향을 미치는 것으로 보고되고 있다.
그러나 최근 저항성 운동과 보조제를 복합처치한 선행 연구들을 살펴보면, Aguiar et al.(2011)의 연구에서는 흰쥐를 대상으로 크레아틴(0.5g/㎏/day)과 수직 점프 운동(5day/week)을 5주 동안 복합처치한 결과, 저항성 운동으로 인한 유의한 근 단면적의 증가만 있었을 뿐, 추가적으로 처치한 크레아틴의 효과는 발견하지 못했으며, 흰쥐를 대상으로 류신(0.135 g/㎏/day)과 스쿼트 운동을 7일 동안 복합처치한 Nicastro et al.(2012)의 연구에서도 저항성 운동의 효과로 인한 plantaris 무게 증가만 있었을 뿐, 추가적으로 처치한 류신의 효과는 나타나지 않은 것으로 보고되고 있어, 본 연구와 비슷한 결과를 보였다.
따라서 저항성 운동과 보조제의 섭취는 근육량 증가에 긍정적인 영향을 미치지만, 저항성 운동과 보조제를 복합처치했을 경우에는 각각의 처치에 대한 additive effect 또는 synergistic effect는 나타나지 않은 것으로 판단된다. 그건 아마도 보조제 보다 저항성 운동이 골격근에 훨씬 더 직접적으로 작용하는 것으로 보이며, 또한 영향을 미치는 정도에 있어서도 저항성 운동의 영향이 보조제의 영향보다 상대적으로 크게 작용하여 추가적으로 처치한 보조제에 대한 영향은 미비한 것으로 판단된다.
또한 soleus와 EDL 근육에서 유의한 차이가 나타나지 않은 것은 본 연구에서 사용된 Hornberger & Farrar(2004)의 운동 프로토콜에 영향을 받은 것으로 보인다. 사다리 타기 운동 특성상 무지 굴곡근인 FHL이 가장 많이 사용되었고, 발목의 저측 굴곡근인 soleus와 족관절의 배측굴곡을 보조하는 EDL 근육의 사용은 적어 유의한 변화가 나타나지 않은 것으로 사료된다.
크레아틴은 골격근 내 ATP 재합성을 증가시켜 무산소성 운동 수행능력을 향상시키는 것으로 보고되고 있으며(Cooper et al., 2012; Kreider, 2003), 류신 또한 운동 중에 손상된 근육을 빠르게 회복시켜 운동수행능력을 향상시키는 것으로 보고되고 있다(Stark et al., 2012; Drummond et al., 2009). 하지만 본 연구에서 나타난 최대 근력의 결과 역시 근육 무게의 결과와 마찬가지로 추가적으로 처치한 보조제의 효과는 나타나지 않았다.
Akt와 mTOR는 단백질 합성 조절을 통해 세포의 성장과 증식을 촉진시키며, 골격근에서는 근육세포의 분화와 융합을 조절하여 근섬유의 크기를 증가시키는 것으로 보고되고 있다. 저항성 운동과 영양 보조제는 이러한 단백질 합성 신호전달 경로를 활성화 시키는 것으로 보고되고 있다(Egan & Zierath, 2013; Ge & Chen, 2012; Bodine, 2006). Bolster et al.(2003)과 Chalé-Rush et al.(2009)의 연구에서는 흰쥐를 대상으로 일회성 저항성 운동과 지속적인 과부하 운동을 시킨 결과 Akt와 mTOR 단백질 발현이 유의하게 증가하였고, mTOR의 하위 인자인 S6K1 단백질 발현 또한 유의한 증가를 보여 저항성 운동이 근 단백질 합성을 촉진시키는 주요한 자극제임을 시사했다. 또한 크레아틴을 처치한 Safdar et al.(2008)과 Deldicque et al.(2007)의 연구와 류신을 처치한 Haegens et al.(2012), Han et al.(2008)의 연구에서도 Akt, mTOR, p70S6K의 발현이 유의하게 증가했음을 보고하고 있어, 크레아틴과 류신 역시 근 단백질 합성 증가에 긍정적인 영향을 미치는 것으로 보고되었다.
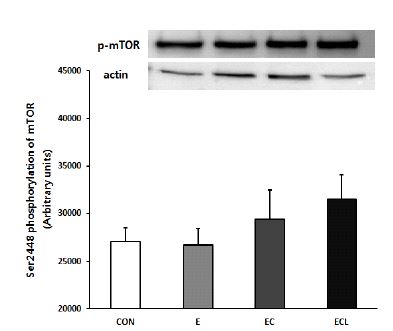
본 연구에서는 보조제를 추가 처치할수록 phospho-mTOR 단백질 발현이 증가하는 경향을 보인 반면, phospho-Akt 단백질 발현은 유의하게 감소한 것으로 나타났다. 이는 선행연구들과는 부분적으로 일치하는 결과로서, 각 단백질마다 자극에 반응하는 시점이 서로 다르기 때문에 phospho-Akt와 phospho-mTOR 단백질 발현정도가 일치하지 않은 것으로 사료된다. Bolster et al.(2003)의 연구에서는 흰쥐를 대상으로 일회성 저항성 운동을 실시한 다음 운동 직후, 휴식 5분, 10분, 15분, 30분, 60분에서 Akt와 mTOR의 발현을 관찰한 결과, mTOR의 발현은 유의한 변화를 보이지 않았으나 Akt의 발현은 점점 증가하다가 5분과 10분에서 유의한 증가를 보인 후 점차 감소하는 변화를 보였고, 또한 Creer et al.(2005)의 연구에서도 성인 남성 8명을 대상으로 탄수화물을 고갈시킨 후 고탄수화물을 처치하여 운동 전, 운동 직후, 운동 종료 10분 후의 Akt와 mTOR의 발현을 비교한 결과, mTOR의 발현에는 유의한 변화를 보이지 않았으나 Akt의 발현은 운동 종료 10분 후에서 유의한 증가를 보였다. 이러한 선행연구들을 살펴보면, Akt가 운동과 같은 자극에 즉시 반응을 보이는 매우 민감한 인자이며, Akt의 발현이 증가하는 시점과 mTOR의 발현이 증가하는 시점이 일치하지 않는다는 것을 알 수 있다. 따라서 본 연구에서는 phospho-Akt의 발현이 훈련 초기에 증가한다는 점을 고려하여 단백질 합성 분석을 다양한 시점에서 실시했었다면, 저항성 운동, 크레아틴, 류신의 처치가 Akt에 미치는 영향을 보다 명확하게 규명할 수 있었을 것이라고 판단된다.
또한 phospho-mTOR 단백질 발현은 집단 간 유의한 차이는 나타나지 않았지만, 보조제를 추가 처치할수록 증가하는 경향을 보임으로써 근육의 무게와 최대 근력의 결과에서 확인하지 못했던 보조제 추가처치에 대한 효과를 세포 내 수준에서 확인할 수 있었다. 따라서 저항성 운동 시 크레아틴, 류신의 추가 처치는 phospho-mTOR의 발현을 증가시키고, 단백질 합성 증가를 통해서 근육량의 증가와 근력 향상에 긍정적인 영향을 미칠 가능성이 존재하는 것으로 사료되며, 추후에는 실험 기간, 보조제의 양을 조정하고 단백질 합성을 촉진시키는 세포 내 환경과 단백질 합성 신호전달 인자들을 조금 더 세밀하게 관찰하는 연구가 필요하다고 사료된다.
결 론
저항성 운동은 근육량의 증가와 근력 향상에 긍정적인 영향을 미치지만, 추가적으로 처치한 크레아틴과 류신의 영향은 미비한 것으로 판단된다. 그러나 세포내 수준에서 phospho-mTOR 단백질 발현이 증가하는 경향을 보임으로써 추후 연구에서는 보조제의 투여량과 투여 기간을 조정하고, 단백질 합성에 관여하는 세포 내·외의 다양한 환경과 신호전달 과정들을 조금 더 세밀하게 관찰한다면 근육량 증가와 근력 향상에 대한 효과를 보다 명확하게 규명할 수 있을 것으로 사료된다.
References
권영섭, 소호성(2007). Brief review of muscle hypertrophy mechanism. 대한운동사회 스포츠건강의학 학술지, 9(2), 13-20.
권 영섭, 소 호성. 2007;Brief review of muscle hypertrophy mechanism. 대한운동사회 스포츠건강의학 학술지 9(2):13–20.Aguiar, A. F., Aguiar, D. H., Felisberto, A. D., Carani, F. R., Milanezi, R. C., Padovani, C. R., & Dal-Pai-Silva, M. (2010). Effects of creatine supplementation during resistance training on myosin heavy chain (MHC) expression in rat skeletal muscle fibers. The Journal of Strength & Conditioning Research, 24(1), 88-96.
Aguiar A. F., Aguiar D. H., Felisberto A. D., Carani F. R., Milanezi R. C., Padovani C. R., et al, Dal-Pai-Silva M.. 2010;Effects of creatine supplementation during resistance training on myosin heavy chain (MHC) expression in rat skeletal muscle fibers. The Journal of Strength & Conditioning Research 24(1):88–96. 10.1519/jsc.0b013e3181aeb103.Aguiar, A. F., de Souza, R. W. A., Aguiar, D. H., Aguiar, R. C. M., Vechetti Jr, I. J., & Dal-Pai-Silva, M. (2011). Creatine does not promote hypertrophy in skeletal muscle in supplemented compared with nonsupplemented rats subjected to a similar workload. Nutrition Research, 31(8), 652-657.
Aguiar A. F., de Souza R. W. A., Aguiar D. H., Aguiar R. C. M., Vechetti Jr I. J., et al, Dal-Pai-Silva M.. 2011;Creatine does not promote hypertrophy in skeletal muscle in supplemented compared with nonsupplemented rats subjected to a similar workload. Nutrition Research 31(8):652–657. 10.1016/j.nutres.2011.08.006.Baar, K., & Esser, K. (1999). Phosphorylation of p70S6kcorrelates with increased skeletal muscle mass following resistance exercise. American Journal of Physiology-Cell Physiology, 276(1), 120-127.
Baar K., et al, Esser K.. 1999;Phosphorylation of p70S6kcorrelates with increased skeletal muscle mass following resistance exercise. American Journal of Physiology-Cell Physiology 276(1):120–127. 10.1152/ajpcell.1999.276.1.c120.Bodine, S. C. (2006). mTOR signaling and the molecular adaptation to resistance exercise. Medicine and Science in Sports and Exercise, 38(11), 1950-1957.
Bodine S. C.. 2006;mTOR signaling and the molecular adaptation to resistance exercise. Medicine and Science in Sports and Exercise 38(11):1950–1957. 10.1249/01.mss.0000233797.24035.35.Bolster, D. R., Kubica, N., Crozier, S. J., Williamson, D. L., Farrell, P. A., Kimball, S. R., & Jefferson, L. S. (2003). Immediate response of mammalian target of rapamycin (mTOR)-mediated signalling following acute resistance exercise in rat skeletal muscle. The Journal of Physiology, 553(1), 213-220.
Bolster D. R., Kubica N., Crozier S. J., Williamson D. L., Farrell P. A., Kimball S. R., et al, Jefferson L. S.. 2003;Immediate response of mammalian target of rapamycin (mTOR)-mediated signalling following acute resistance exercise in rat skeletal muscle. The Journal of Physiology 553(1):213–220. 10.1113/jphysiol.2003.047019.Bradford, M. M. (1976). A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, 72(1), 248-25.
Bradford M. M.. 1976;A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry 72(1):248–25. 10.1006/abio.1976.9999.Burke, D. G., Candow, D. G., Chilibeck, P. D., MacNeil, L. G., Roy, B. D., Tarnopolsky, M. A., & Ziegenfuss, T. (2008). Effect of creatine supplementation and resistance-exercise training on muscle insulin-like growth factor in young adults. International Journal of Sport Nutrition and Exercise Metabolism, 18(4), 389-398.
Burke D. G., Candow D. G., Chilibeck P. D., MacNeil L. G., Roy B. D., Tarnopolsky M. A., et al, Ziegenfuss T.. 2008;Effect of creatine supplementation and resistance-exercise training on muscle insulin-like growth factor in young adults. International Journal of Sport Nutrition and Exercise Metabolism 18(4):389–398. 10.1123/ijsnem.18.4.389.Chalé-Rush, A., Morris, E. P., Kendall, T. L., Brooks, N. E., & Fielding, R. A. (2009). Effects of chronic overload on muscle hypertrophy and mTOR signaling in young adult and aged rats. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences, 64(12), 1232-1239.
Chalé-Rush A., Morris E. P., Kendall T. L., Brooks N. E., et al, Fielding R. A.. 2009;Effects of chronic overload on muscle hypertrophy and mTOR signaling in young adult and aged rats. The Journals of Gerontology Series A: Biological Sciences and Medical Sciences 64(12):1232–1239.Cooper, R., Naclerio, F., Allgrove, J., & Jimenez, A. (2012). Creatine supplementation with specific view to exercise/ sports performance: an update. Journal of the International Society of Sports Nutrition, 9(33), 1-11.
Cooper R., Naclerio F., Allgrove J., et al, Jimenez A.. 2012;Creatine supplementation with specific view to exercise/ sports performance: an update. Journal of the International Society of Sports Nutrition 9(33):1–11. 10.1186/1550-2783-9-33.Creer, A., Gallagher, P., Slivka, D., Jemiolo, B., Fink, W., & Trappe, S. (2005). Influence of muscle glycogen availability on ERK1/2 and Akt signaling after resistance exercise in human skeletal muscle. Journal of Applied Physiology, 99(3), 950-956.
Creer A., Gallagher P., Slivka D., Jemiolo B., Fink W., et al, Trappe S.. 2005;Influence of muscle glycogen availability on ERK1/2 and Akt signaling after resistance exercise in human skeletal muscle. Journal of Applied Physiology 99(3):950–956. 10.1152/japplphysiol.00110.2005.de Campos-Ferraz, P. L., Ribeiro, S. M. L., dos Santos Luz, S., Lancha Jr, A. H., & Tirapegui, J. (2011). Exercise x BCAA supplementation in young trained rats: what are their effects on body growth?. Journal of Sports Science and Medicine, 10(3), 483-490.
de Campos-Ferraz P. L., Ribeiro S. M. L., dos Santos Luz S., Lancha Jr A. H., et al, Tirapegui J.. 2011;Exercise x BCAA supplementation in young trained rats: what are their effects on body growth? Journal of Sports Science and Medicine 10(3):483–490.Deldicque, L., Theisen, D., Bertrand, L., Hespel, P., Hue, L., & Francaux, M. (2007). Creatine enhances differentiation of myogenic C2C12 cells by activating both p38 and Akt/PKB pathways. American Journal of Physiology-Cell Physiology, 293(4), 1263-1271.
Deldicque L., Theisen D., Bertrand L., Hespel P., Hue L., et al, Francaux M.. 2007;Creatine enhances differentiation of myogenic C2C12 cells by activating both p38 and Akt/PKB pathways. American Journal of Physiology-Cell Physiology 293(4):1263–1271. 10.1152/ajpcell.00162.2007.Deldicque, L., Louis, M., Theisen, D., Nielens, H., Dehoux, M., Thissen, J. P., Rennie, M. J., & Francaux, M. (2005). Increased IGF mRNA in human skeletal muscle after creatine supplementation. Medicine and Science in Sports and Exercise, 37(5), 731-736.
Deldicque L., Louis M., Theisen D., Nielens H., Dehoux M., Thissen J. P., Rennie M. J., et al, Francaux M.. 2005;Increased IGF mRNA in human skeletal muscle after creatine supplementation. Medicine and Science in Sports and Exercise 37(5):731–736. 10.1249/01.mss.0000162690.39830.27.Drummond, M. J., Dreyer, H. C., Fry, C. S., Glynn, E. L., & Rasmussen, B. B. (2009). Nutritional and contractile regulation of human skeletal muscle protein synthesis and mTORC1 signaling. Journal of Applied Physiology, 106(4), 1374-1384.
Drummond M. J., Dreyer H. C., Fry C. S., Glynn E. L., et al, Rasmussen B. B.. 2009;Nutritional and contractile regulation of human skeletal muscle protein synthesis and mTORC1 signaling. Journal of Applied Physiology 106(4):1374–1384. 10.1152/japplphysiol.91397.2008.Egan, B., & Zierath, J. R. (2013). Exercise Metabolism and the Molecular Regulation of Skeletal Muscle Adaptation. Cell Metabolism, 17(2), 162-184.
Egan B., et al, Zierath J. R.. 2013;Exercise Metabolism and the Molecular Regulation of Skeletal Muscle Adaptation. Cell Metabolism 17(2):162–184. 10.1016/j.cmet.2012.12.012.Franco, F. S., Costa, N. M., Ferreira, S. A., Carneiro-Junior, M. A., & Natali, A. J. (2011). The effects of a high dosage of creatine and caffeine supplementation on the lean body mass composition of rats submitted to vertical jumping training. Journal of the International Society of Sports Nutrition, 8(1), 1-8.
Franco F. S., Costa N. M., Ferreira S. A., Carneiro-Junior M. A., et al, Natali A. J.. 2011;The effects of a high dosage of creatine and caffeine supplementation on the lean body mass composition of rats submitted to vertical jumping training. Journal of the International Society of Sports Nutrition 8(1):1–8. 10.1186/1550-2783-8-3.Ge, Y., & Chen, J. (2012). Mammalian target of rapamycin (mTOR) signaling network in skeletal myogenesis. Journal of Biological Chemistry, 287(52), 43928-43935.
Ge Y., et al, Chen J.. 2012;Mammalian target of rapamycin (mTOR) signaling network in skeletal myogenesis. Journal of Biological Chemistry 287(52):43928–43935. 10.1074/jbc.r112.406942.Glass, D. J. (2003). Signalling pathways that mediate skeletal muscle hypertrophy and atrophy. Nature Cell Biology, 5(2), 87-90.
Glass D. J.. 2003;Signalling pathways that mediate skeletal muscle hypertrophy and atrophy. Nature Cell Biology 5(2):87–90. 10.1038/ncb0203-87.Haegens, A., Schols, A. M., van Essen, A. L., van Loon, L. J., & Langen, R. C. (2012). Leucine induces myofibrillar protein accretion in cultured skeletal muscle through mTOR dependent and -independent control of myosin heavy chain mRNA levels. Molecular Nutrition and Food Research, 56(5), 741-752.
Haegens A., Schols A. M., van Essen A. L., van Loon L. J., et al, Langen R. C.. 2012;Leucine induces myofibrillar protein accretion in cultured skeletal muscle through mTOR dependent and -independent control of myosin heavy chain mRNA levels. Molecular Nutrition and Food Research 56(5):741–752. 10.1002/mnfr.201100695.Han, B., Tong, J., Zhu, M. J., Ma, C., & Du, M. (2008). Insulin like growth factor 1 (IGF 1) and leucine activate pig myogenic satellite cells through mammalian target of rapamycin (mTOR) pathway. Molecular Reproduction and Development, 75(5), 810-817.
Han B., Tong J., Zhu M. J., Ma C., et al, Du M.. 2008;Insulin like growth factor 1 (IGF 1) and leucine activate pig myogenic satellite cells through mammalian target of rapamycin (mTOR) pathway. Molecular Reproduction and Development 75(5):810–817. 10.1002/mrd.20832.Hay, N., & Sonenberg, N. (2004). Upstream and downstream of mTOR. Genes and Development, 18(16), 1926-1945.
Hay N., et al, Sonenberg N.. 2004;Upstream and downstream of mTOR. Genes and Development 18(16):1926–1945. 10.1101/gad.1212704.Hornberger Jr, T. A., & Farrar, R. P. (2004). Physiological hypertrophy of the FHL muscle following 8 weeks of progressive resistance exercise in the rat. Canadian Journal of Applied Physiology, 29(1), 16-31.
Hornberger Jr T. A., et al, Farrar R. P.. 2004;Physiological hypertrophy of the FHL muscle following 8 weeks of progressive resistance exercise in the rat. Canadian Journal of Applied Physiology 29(1):16–31.Jewell, J. L., Russell, R. C., & Guan, K. L. (2013). Amino acid signalling upstream of mTOR. Nature Reviews Molecular Cell Biology, 14, 133-139.
Jewell J. L., Russell R. C., et al, Guan K. L.. 2013;Amino acid signalling upstream of mTOR. Nature Reviews Molecular Cell Biology 14:133–139. 10.1038/nrm3522.Jówko, E., Ostaszewski, P., Jank, M., Sacharuk, J., Zieniewicz, A., Wilczak, J., & Nissen, S. (2001). Creatine and beta-hydroxy-beta-methylbutyrate (HMB) additively increase lean body mass and muscle strength during a weight-training program. Nutrition, 17(7-8), 558-566..
Jówko E., Ostaszewski P., Jank M., Sacharuk J., Zieniewicz A., Wilczak J., et al, Nissen S.. 2001;Creatine and beta-hydroxy-beta-methylbutyrate (HMB) additively increase lean body mass and muscle strength during a weight-training program. Nutrition 17(7-8):558–566.Kell, R. T., Bell, G., & Quinney, A. (2001). Musculoskeletal fitness, health outcomes and quality of life. Sports Medicine, 31(12), 863-873.
Kell R. T., Bell G., et al, Quinney A.. 2001;Musculoskeletal fitness, health outcomes and quality of life. Sports Medicine 31(12):863–873. 10.2165/00007256-200131120-00003.Kreider, R. B. (2003). Effects of creatine supplementation on performance and training adaptations. Molecular and Cellular Biochemistry, 244(1-2), 89-94.
Kreider R. B. 2003;Effects of creatine supplementation on performance and training adaptations. Molecular and Cellular Biochemistry 244(1-2):89–94.Laemmli, U. K. (1970). Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 227(5259), 680–685.
Laemmli U. K.. 1970;Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227(5259):680–685. 10.1038/227680a0.Leenders, M., Verdijk, L. B., Van der Hoeven, L., Van Kranenburg, J., Nilwik, R., Wodzig, W. K., Senden, J. M., Keizer, H. A., & Van Loon, L. J. (2013). Protein supplementation during resistance-type exercise training in the elderly. Medicine and Science in Sports and Exercise, 45(3), 542-552.
Leenders M., Verdijk L. B., Van der Hoeven L., Van Kranenburg J., Nilwik R., Wodzig W. K., Senden J. M., Keizer H. A., et al, Van Loon L. J.. 2013;Protein supplementation during resistance-type exercise training in the elderly. Medicine and Science in Sports and Exercise 45(3):542–552. 10.1249/mss.0b013e318272fcdb.Meijer, A. J., & Dubbelhuis, P. F. (2004). Amino acid signalling and the integration of metabolism. Biochemical and Biophysical Research Communications, 313(2), 397-403.
Meijer A. J., et al, Dubbelhuis P. F.. 2004;Amino acid signalling and the integration of metabolism. Biochemical and Biophysical Research Communications 313(2):397–403. 10.1016/j.bbrc.2003.07.012.Miyazaki, M., & Esser, K. A. (2009). Cellular mechanisms regulating protein synthesis and skeletal muscle hypertrophy in animals. Journal of Applied Physiology, 106(4), 1367-1373.
Miyazaki M., et al, Esser K. A.. 2009;Cellular mechanisms regulating protein synthesis and skeletal muscle hypertrophy in animals. Journal of Applied Physiology 106(4):1367–1373. 10.1152/japplphysiol.91355.2008.Nicastro, H., Zanchi, N. E., da Luz, C. R., de Moraes, W. M., Ramona, P., de Siqueira Filho, M. A., Chaves, D. F., Medeiros, A., Brum, P. C., Dardevet, D., & Lancha Jr, A. H. (2012). Effects of leucine supplementation and resistance exercise on dexamethasone-induced muscle atrophy and insulin resistance in rats. Nutrition, 28(4), 465-471.
Nicastro H., Zanchi N. E., da Luz C. R., de Moraes W. M., Ramona P., de Siqueira Filho M. A., Chaves D. F., Medeiros A., Brum P. C., Dardevet D., et al, Lancha Jr A.. 2012;Effects of leucine supplementation and resistance exercise on dexamethasone-induced muscle atrophy and insulin resistance in rats. Nutrition 28(4):465–471. 10.1016/j.nut.2011.08.008.Nissen, S. L., & Sharp, R. L. (2003). Effect of dietary supplements on lean mass and strength gains with resistance exercise: a meta-analysis. Journal of Applied Physiology, 94(2), 651-659.
Nissen S. L., et al, Sharp R. L.. 2003;Effect of dietary supplements on lean mass and strength gains with resistance exercise: a meta-analysis. Journal of Applied Physiology 94(2):651–659. 10.1152/japplphysiol.00755.2002.Olsen, S., Aagaard, P., Kadi, F., Tufekovic, G., Verney, J., Olesen, J. L., Suetta, C., & Kjær, M. (2006). Creatine supplementation augments the increase in satellite cell and myonuclei number in human skeletal muscle induced by strength training. The Journal of Physiology, 573(2), 525-534.
Olsen S., Aagaard P., Kadi F., Tufekovic G., Verney J., Olesen J. L., Suetta C., et al, Kjær M.. 2006;Creatine supplementation augments the increase in satellite cell and myonuclei number in human skeletal muscle induced by strength training. The Journal of Physiology 573(2):525–534. 10.1113/jphysiol.2006.107359.Pasiakos, S. M., & McClung, J. P. (2011). Supplemental dietary leucine and the skeletal muscle anabolic response to essential amino acids. Nutrition Reviews, 69(9), 550-557.
Pasiakos S. M., et al, McClung J. P.. 2011;Supplemental dietary leucine and the skeletal muscle anabolic response to essential amino acids. Nutrition Reviews 69(9):550–557. 10.1111/j.1753-4887.2011.00420.x.Pasiakos, S. M. (2012). Exercise and amino acid anabolic cell signaling and the regulation of skeletal muscle mass. Nutrients, 4(7), 740-758.
Pasiakos S. M.. 2012;Exercise and amino acid anabolic cell signaling and the regulation of skeletal muscle mass. Nutrients 4(7):740–758. 10.3390/nu4070740.Safdar, A., Yardley, N. J., Snow, R., Melov, S., & Tarnopolsky, M. A. (2008). Global and targeted gene expression and protein content in skeletal muscle of young men following short-term creatine monohydrate supplementation. Physiological Genomics, 32(2), 219-228.
Safdar A., Yardley N. J., Snow R., Melov S., et al, Tarnopolsky M. A.. 2008;Global and targeted gene expression and protein content in skeletal muscle of young men following short-term creatine monohydrate supplementation. Physiological Genomics 32(2):219–228. 10.1152/physiolgenomics.00157.2007.Schoenfeld, B. J. (2010). The mechanisms of muscle hypertrophy and their application to resistance training. The Journal of Strength & Conditioning Research, 24(10), 2857-2872.
Schoenfeld B. J.. 2010;The mechanisms of muscle hypertrophy and their application to resistance training. The Journal of Strength & Conditioning Research 24(10):2857–2872. 10.1519/jsc.0b013e3181e840f3.Stark, M., Lukaszuk, J., Prawitz, A., & Salacinski, A. (2012). Protein timing and its effects on muscular hypertrophy and strength in individuals engaged in weight-training. Journal of the International Society of Sports Nutrition, 9(1), 1-8.
Stark M., Lukaszuk J., Prawitz A., et al, Salacinski A.. 2012;Protein timing and its effects on muscular hypertrophy and strength in individuals engaged in weight-training. Journal of the International Society of Sports Nutrition 9(1):1–8. 10.1186/1550-2783-9-54.Willoughby, D. S., & Rosene, J. M. (2003). Effects of oral creatine and resistance training on myogenic regulatory factor expression. Medicine and Science in Sports and Exercise, 35(6), 923-929.
Willoughby D. S., et al, Rosene J. M.. 2003;Effects of oral creatine and resistance training on myogenic regulatory factor expression. Medicine and Science in Sports and Exercise 35(6):923–929. 10.1249/01.mss.0000069746.05241.f0.Wullschleger, S., Loewith, R., & Hall, M. N. (2006). TOR signaling in growth and metabolism. Cell, 124(3), 471-484.
Wullschleger S., Loewith R., et al, Hall M. N.. 2006;TOR signaling in growth and metabolism. Cell 124(3):471–484. 10.1016/j.cell.2006.01.016.Young, R. E., & Young, J. C. (2007). The effect of creatine supplementation on mass and performance of rat skeletal muscle. Life Sciences, 81(9), 710-716.
Young R. E., et al, Young J. C.. 2007;The effect of creatine supplementation on mass and performance of rat skeletal muscle. Life Sciences 81(9):710–716. 10.1016/j.lfs.2007.06.029.