Citrulline 섭취가 20대 남성의 일회성 유산소운동후 혈압, 심혈관기능 및 혈중 젖산농도에 미치는 영향
Effects of citrulline supplementation on blood pressure, cardiovascular function, and blood lactate after a bout of aerobic exercise in 20s males
Article information
Abstract
일회성 운동 후에 나타나는 운동후 저혈압(post-exercise hypotension: PEH) 반응은 운동 트레이닝을 통한 혈압 감소의 주요 기전으로 알려져 있으며, citrulline의 섭취는 체내 일산화 질소(nitric oxide: NO)를 증가시켜 혈압을 감소시키는 것으로 알려져 있으나, citrulline 섭취가 PEH에 미치는 영향을 규명한 연구가 매우 부족한 실정이다. 따라서 이 연구에서는 고혈압 전단계와 정상혈압 범주의 20대 남성을 대상으로 citrulline 섭취가 PEH에 미치는 영향을 규명하고자 하였다. 각각 4일간의 citrulline 처치와 placebo 처치(비처치)가 안정시와 VO2max 70% 강도로 30분간 실시한 유산소운동 후 회복기 중 혈압, 심혈관기능, 그리고 혈중 젖산농도에 미치는 영향을 비교ㆍ분석하였다. 모든 대상자는 citrulline 처치 실험과 placebo 처치 실험에 counter- balanced order에 따라 반복 참여하였다. 이 연구의 주요 결과를 요약하여 기술하면 다음과 같다. 1) Citrulline 처치를 한 경우 회복기 10~60분 시점에서 SBP와 DBP, 그리고 MAP가 비처치에 비하여 유의하게 낮게 나타났다. RPP는 citrulline 처치가 비처치에 비하여 회복기 30분과 45분 시점에서 유의하게 낮은 것으로 나타났다. 2) Citrulline 처치와 비처치 간에 안정시와 회복기 중 SV를 제외한 HR, CO, 그리고 TPR은 유의한 차이가 나타나지 않았다. 각 처치 내에서 HR, SV, CO, 그리고 TPR 모두 시기 간에는 유의한 차이가 나타났다. 3) Citrulline 처치와 비처치 간에 안정시와 회복기 중 혈중 젖산농도는 유의한 차이가 나타나지 않았다. 이상의 결과를 종합해 보면, citrulline 처치가 비처치에 비하여 PEH 반응을 더욱 크게 나타나도록 하였으며, citrulline 처치가 혈압만 낮출 뿐 심장에 대한 부담 또는 기타 심혈관계 반응에는 큰 영향을 미치지 않는 것으로 나타났다. 즉, 단기간의 citrulline 섭취가 심장에 부담을 주지 않으면서 PEH 반응을 더 크게 하는 효과적인 처치라고 결론지을 수 있다. 향후 고혈압환자를 대상으로 하는 후속 연구가 요청되며, 이들을 대상으로도 이 연구과 유사한 결과가 나타난다면 장기간에 걸쳐 citrulline을 섭취하면서 운동 트레이닝을 하면 더 큰 PEH 반응이 누적되어 고혈압환자의 혈압 감소에 더욱 효과적일 것으로 기대된다. 향후 고혈압환자를 대상으로 운동 트레이닝의 혈압감소 효과를 검증하는 과정에서 citrulline 섭취 여부에 따른 효과를 규명하는 연구가 요청된다.
Trans Abstract
It has well known that post-exercise hypotension (PEH) after a bout of aerobic exercise was a major mechanism to reduce blood pressure though exercise training, and that citrulline supplementation reduced blood pressure by increasing nitric oxide in vivo. However, the effects of citrulline supplementation on PEH have not been fully elucidated yet. This study was designed to examine the effects of citrulline supplementation on PEH after a bout of aerobic exercise in prehypertensive and normotensive 20s males. The effects of a four-day citrulline or placebo treatment on blood pressure, cardiovascular function, and blood lactate concentration measured at rest and during recovery phase after a bout of exercise performed for 30 min at 70% VO2max were compared and analyzed. All subjects participated in a citrulline trial and a placebo trial repeatedly according to a counter-balanced order. Main results of the present study were as follows: 1) Systolic blood pressure, diastolic blood pressure, and mean arterial pressure measured at 10-60 min of recovery phase in citrulline trial were significantly lower than placebo trial. Rate-pressure product measured at 30 min and 45 min of the recovery phase in citrulline trial was significantly lower than placebo trial. 2) No significant differences were found in heart rate (HR), cardiac output (CO), and total peripheral resistance (TPR) measured during the recovery phase between two trials. There were significant differences in HR, stroke volume, CO, and TPR among times within a trial. 3) No significant difference was found in blood lactate concentration measured at rest and during the recovery phase between two trials. The results would be summarized that the PEH was augmented by the citrulline supplementation, and that burden to cardiac muscle as well as cardiovascular function were not affected by the citrulline supplementation. It was concluded that the short-term citrulline supplementation would be very effective to augment the PEH. A research investigating the effects of citrulline supplementation on the PEH in pre-hypertensive and/or hypertensive individuals would be warranted. In addition, a study examining the effects of citrulline supplementation during long-term exercise training on the blood pressure in hypertensive patients also would be warranted in near future.
서 론
전 세계적으로 심혈관질환은 주요 사망원인 중 하나로서, 심혈관질환자의 1/3은 고혈압(hypertension)에 해당된다(World Health Organization, 2013). 고혈압이 문제가 되는 이유는 심혈관질환, 뇌혈관질환, 그리고 신장질환 등 다양한 합병증을 유발하기 때문이다(Burt et al., 1995). 고혈압환자의 95% 이상이 원인을 모르는 본태성 고혈압으로 여러 유발원인으로 제시되어 왔으나 명확한 기전이 밝혀지지 않아 그 심각성을 더하고 있다(Arakawa, 1995). 그 동안 운동과학 분야의 연구를 통하여 규칙적인 유산소운동이 고혈압의 개선에 효과적인 것으로 알려져 왔다(MacDonald et al., 2000; Halliwill et al., 2013). 고혈압환자를 대상으로 일회성 유산소운동을 실시한 결과 수축기혈압(systolic blood pressure: SBP)과 이완기혈압(diastolic blood pressure: DBP)이 운동후 회복기 중에 8~9 mmHg 감소되었고, 이와 같은 혈압감소 반응이 회복기 중에 수 시간 동안 유지되었다. 따라서 유산소운동을 장기간에 걸쳐 지속적으로 실시할 경우 일회성 유산소운동후 혈압감소 반응이 누적되어 혈압을 감소시킬 수 있다는 주장이 제기되었다(Chobanian et al., 2003).
혈압과 관련하여 운동후 저혈압(post-exercise hypotension : PEH)은 매우 중요한 주제로서, 이는 일회성 운동 후 회복기 중에 SBP와 DBP가 안정시 수치보다 낮아지는 상태를 의미한다. 운동을 할 때마다 나타나는 반복적으로 나타나는 PEH가 누적되는 것으로 운동 트레이닝을 통한 고혈압환자의 혈압 감소를 설명할 수 있다(Chobanian et al., 2003). Cleroux et al.(1992)은 본태성 고혈압환자를 대상으로 유산소운동을 실시한 결과 회복기 중에 SBP와 DBP가 각각 11 mmHg와 4 mmHg씩 감소되었으며, 회복기 중 혈압이 감소된 상태로 약 2시간 지속되었다고 보고하였다. 이와 같은 PEH 반응이 장기간에 걸쳐 반복적으로 나타날 경우 고혈압의 개선을 통하여 심혈관질환자에게 긍정적인 영향을 줄 수 있을 것이라고 보고되었다(Cleroux et al., 1992).
PEH는 걷기, 달기기, 사이클, 그리고 수영을 포함한 다양한 유산소운동 후에 나타났고(Boone et al., 1992; Kiviniemi et al., 2014), 회복기 10분 동안 나타나기도 하고, 길게는 170분까지 지속되는 것으로 보고되었다(Seals et al., 1988). PEH가 관찰된 대부분의 연구에서는 20~60분간의 유산소운동을 실시하였고, PEH는 주로 30~60분 동안 나타났다. 이와 같은 PEH 반응은 고혈압환자와 정상혈압자 모두에서 나타난 것으로 보고되었다(Beaulieu et al., 1993; MacDonald et al., 1999). PEH는 운동 중 근육활동이 지속적으로 혈관 이완작용을 유도하여 나타나며, 동시에 교감신경을 활성화시켜 혈관 수축 신호를 감소시킴으로써 나타난다. PEH의 누적이 고혈압환자의 혈압 감소에 영향을 준다고 보고된 이래, 최근에는 PEH를 증가시켜 혈압의 감소를 보다 효과적으로 유도하는 특정 처치를 모색하는 연구가 활발하게 이루어져 왔다(Halliwill et al., 2013).
그 하나의 처치 방법으로 citrulline 섭취를 들 수 있다. Citrulline은 1930년 수박의 즙에서 처음 발견되어 분리된 일종의 유리 아미노산으로서, 자연계에 널리 존재하며, arginine과 ornithine 등과 같이 요소회로(urea cycle)의 중간체로서 중요한 의미를 갖는다(Takeda et al., 2011). Citrulline은 혈액으로부터 질소를 제거하고, 요소로 전환되는 과정에 중요한 기능을 발휘하며, 일부 사람에게서 결핍되어 있는 arginine의 형성을 돕는 기능을 가지고 있다(Marini et al., 2012). Arginine의 가장 중요한 역할은 산화질소(nitric oxide: NO)를 생성하는 것이며, citrulline은 arginine을 생성하는 전구체가 되는 것이다. NO는 강력한 혈관 이완자(vasodilator)로서, 혈류의 흐름을 조절하며(Boger et al., 2008), 혈압과 혈관저항성(vascular resistance)을 낮추는 역할을 한다(Stamler et al., 2001). 즉, citrulline을 섭취하면 체내에서 arginine의 합성을 증가시키고, NO 생성을 증가시켜 혈관을 확장시키고, 궁극적으로 혈압을 감소시키는 결과를 얻을 것으로 기대된다.
이에 더하여 citrulline은 arginine보다 반감기가 길기 때문에 혈관 확장에 있어서 arginine보다 더 효과적일 수 있다(Mohrman & Regal, 1988). 아울러 동일한 양을 섭취하였을 경우 citrulline이 arginine에 비해 혈장 내 arginine 농도와 NO의 증가에 보다 효과적인 것으로 보고되었다(Schwedhelm et al., 2008). Citrulline을 섭취하는 것은 arginine 자체를 섭취하는 것보다 체내 arginine의 수치를 증가시키는데 더 효과적일 수 있다고 보고되었다(Lomonosova et al., 2011). 이는 arginine의 경우 섭취량의 30%가 urea cycle를 거쳐 요로로 배출되는 반면, citrulline을 섭취하면 직접적으로 신장에 이동을 하게 되고 간에 공급되지 않기 때문이다(Curis et al., 2005). 한편, 선행 연구의 따르면 수박 3.3 kg을 섭취하였을 때 혈중 citrulline 수치는 22 mmol·L-1에서 595 mmol·L-1로 증가된 반면, 혈중 arginine 수치는 65 mmol·L-1에서 199 mmol·L-1로 증가되는데 그쳤다는 결과를 통하여 수박이 citrulline의 주요 공급원이라고 보고되었다(Mandel & Korman, 2005). Citrulline의 arginine에 대한 상대적 장점을 보고한 다른 연구도 있었다. Figueroa et al.(2014)의 연구에 의하면 arginine의 섭취는 구역질, 복통, 그리고 설사 등의 부작용을 유발할 수 있어 고협압환자에게 권하기 어렵지만, 자연계에서 쉽게 접할 수 있고 대중적인 수박 속에 풍부한 citrulline은 NO 생성의 전구체인 arginine을 부작용이 없이 증가시킬 수 있어 매우 효과적인 혈관확장 보조물이 될 수 있다고 주장하였다.
이상에서 살펴본 바와 같이, citrulline은 자연계에 존재하며 쉽게 접할 수 있는 강력한 혈관확장 물질로서 고혈압환자의 혈압의 감소를 위한 보조물로서 효용 가치가 클 것으로 기대된다. 이에 더하여 citrulline의 섭취는 운동 중 생성되는 혈중 암모니아 수치와 혈중 젖산농도를 감소시켜 피로를 경감함으로써 운동능력을 향상시키고(Takeda et al., 2011; Kashani et al., 2014), 유산소성 에너지의 생성능력을 증가시키며(Bendahan et al., 2002; Giannesini et al., 2009), 혈관탄성의 개선에도 공헌할 것이라고 보고되었다(Ochiai et al., 2012). 따라서 이와 같이 혈관의 기능에 다양한 긍정적인 효과를 주는 citrulline을 섭취하는 것은 일회성 유산소운동 후 나타나는 PEH 반응을 보다 크게 할 수 있을 것으로 기대된다. 그러나 아직 단기간의 citrulline 섭취가 PEH에 미치는 영향을 규명한 연구가 국내·외적으로 매우 미흡한 실정이다. 이에 이 연구에서는 20대 남성 정상혈압자를 대상으로 citrulline 섭취가 일회성 유산소운동후 혈압, 심혈관기능, 그리고 혈중 젖산농도에 미치는 영향을 살펴봄으로써 4일간의 citrulline 섭취가 PEH에 미치는 영향을 규명하고자 하였다.
연구 방법
연구 대상자
이 연구의 대상자는 SBP가 130 mmHg 이하이고, DBP가 90 mmHg 이하인 고혈압 전단계와 정상혈압 범주의 20대 남성으로서 최근 6개월 내에 체계적인 트레이닝 경험이 없고, 정형외과적인 문제와 정신적으로 특별한 사유가 없으며, 혈압 반응에 영향을 주는 약물을 복용하지 않는 자 12명을 선정하였다. 1차 측정 후 wash-out 기간 중 1명이 허리부상으로 중도 탈락하여 11명의 결과를 최종 분석에 포함시켰다. 연구 시작 전 대상자에게 연구의 목적과 절차를 충분히 설명하였으며, 이를 이해하고 자발적으로 참여하고자 하는 자로부터 검사 동의서(informed consent form)와 건강력 설문지(health history questionnaire: HHQ)의 서명을 받은 후 연구에 참여하도록 하였다. 연구 대상자의 신체적 특성은 <Table 1>에 제시된 바와 같다.
연구 절차
이 연구에서는 20대 남성을 대상으로 citrulline 처치와 비처치가 일회성 유산소운동 후 혈압, 심혈관기능, 그리고 혈중 젖산농도에 미치는 영향을 알아보기 위하여 counter-balanced order에 따라 반복측정을 실시하였다. 본 연구의 절차는 다음과 같다. 1) 모든 대상자가 최대운동부하검사를 실시하여 최대산소섭취량(maximal oxygen consumption: VO2max)을 측정하였다. 이 수치를 토대로 유산소운동 검사 중 VO2max의 70%에 해당되는 강도를 결정하였다. 2) 4일의 citrulline 처치 또는 placebo 처치 후 유산소운동 검사(VO2max 70%, 30분)를 실시하였다. 3) 7일간의 wash-out 기간이 지난 후 citrulline 처치를 받았던 대상자는 placebo 처치를, 그리고 placebo 처치를 받았던 대상자는 citrulline 처치를 4일간 한 다음 전과 동일한 방법으로 유산소운동 검사를 실시하였다. 4) 모든 실험을 마친 후 citrulline 처치와 비처치 간에 안정시와 회복기 중 주요 종속변인을 비교하였다.
Citrulline과 placebo 섭취 방법
Citrulline 처치와 placebo 처치를 단일맹검교차법(single blind and cross over)에 따라 적용하였다. Citrulline을 처치하는 방법은 많은 선행연구(Hickner et al., 2006; Ochiai et al., 2012; Figueroa et al., 2014)를 참조하여 결정하였다. 성인의 일일 citrulline 권장 섭취량이 6g이라고 제시한 Figueroa et al.(2012)의 연구에 근거하여, 이 연구에서도 하루에 6g씩 섭취하도록 하였다. 하루 2회에 걸쳐 오전 공복시 3g, 그리고 오후 공복시 3 g을 각각 물 250 ml와 함께 섭취하도록 하였으며, 이와 같은 방법으로 유산소운동 검사 전 4일간 citrulline을 섭취하도록 처치하였다. Citrulline은 캡슐(Source natural, USA) 제품으로, 1 캡슐 당 500mg의 함량이었다.
한편, placebo 처치시 캡슐 충전기를 이용하여 젤라틴 형태의 캡슐을 제조한 뒤 섬유소(cellulose)의 가루를 넣어 육안으로 citrulline과 구분할 수 없게 제작하여 동일한 방법으로 섭취하도록 하였다. 또한 섭취가 용이하도록 약포지를 사용하여 섭취 일자와 섭취 시간대를 각각 기입하여 각 대상자에게 제공하였다. Citrulline 또는 placebo 섭취를 제대로 하는지 여부를 연구자가 직접 확인하였으며, 섭취 기간 동안 식습관을 포함하여 기타 생활습관을 평소와 같이 유지하도록 하였다.
측정 항목과 방법
모든 대상자에게 처치기간 동안 음주, 흡연, 약물 복용, 카페인 섭취, 그리고 고강도의 운동을 금지시켰으며, 실험 전날 7시간 이상 수면을 취한 후 12시간 이상 공복 상태로 실험실에 오도록 하였다. 구체적인 측정 항목과 방법은 다음과 같다.
체격과 신체구성
신장과 체중은 자동 신장체중계(BIKI200, Jawon medical, Daejeon, Korea)를 이용하여 측정하였다. 대상자는 최대한 가벼운 복장을 입고, 발뒤꿈치를 가지런히 붙이고, 무릎과 허리를 똑바로 편 상태에서 머리와 시선이 전방을 향하게 한 후 측정을 실시하였다. 체질량지수(kg·m-2)는 체중(kg)을 신장의 제곱(m2)으로 나누어 산출하였다. 체지방률(%), 근육량(kg), 그리고 체지방량(kg)을 측정하기 위하여 생체전기저항분석기(X-can plusⅡ, Jawon medical, Daejeon, Korea)를 사용하였다. 대상자가 전극판 위에 발을 맞추어 서게 한 후 양손으로 전극 손잡이를 잡게 하였고, 측정 중 움직임을 삼가도록 하였다.
혈압
혈압은 수은혈압계(Kenzmedio, Saitama, Japan)를 이용하여 측정하였다. 대상자의 안정시 혈압을 측정하기 위해 측정당일 실험실 도착 후 의자에 앉아 약 10분간 안정을 취하도록 하였다. 대상자에 좌완을 심장의 높이와 같도록 놓은 후 커프(cuff)를 착용시켰고, 상완동맥에 청진기(stethoscope)를 고정시켜 SBP와 DBP를 5분 간격으로 2회 측정하여 평균값을 산출하였다. 운동후 회복기 5분, 10분, 15분, 30분, 45분, 그리고 60분에도 안정시 측정과 동일한 방법으로 혈압을 측정하였다. 한편, 평균동맥압(mean arterial pressure: MAP)과 심근부담지수(rate pressure product: RPP)를 산출한 공식은 다음과 같다.
심혈관기능관련 변인
대상자의 안정시 심혈관기능관련 변인을 측정하기 위하여 혈압을 측정하는 조건과 동일하게 의자에 등을 기대고 앉아서 10분간 충분한 휴식을 취하도록 하였다. 심박수(heart rate: HR), 1회 박출량(stroke volume: SV), 그리고 심박출량(cardiac output: CO)을 측정하기 위해 6개의 전극을 경동맥과 심장 부위에 부착하는 Physioflow(PF-05, Manatec biomedical, Paris, France)를 사용하였다. CO와 말초혈관 저항(total peripheral resistance: TPR)은 다음의 공식을 적용하여 산출하였다.
운동후 회복기 5분, 10분, 15분, 30분, 45분, 그리고 60분에도 안정시 측정과 동일한 방법으로 이상에서 기술한 심혈관기능관련 변인을 측정하였다.
혈중 젖산농도
혈중 젖산농도(blood lactate concentration)를 측정하기 위하여 finger tip 방법으로 채혈을 하였다. 혈액을 모세관(capillary tube)에 절반 정도 채우는 동안 혈액에 기포가 형성되지 않도록 유의하였으며, 자동젖산분석기(YSI 1500, Instruments, Ohio, USA)를 이용하여 혈중 젖산농도를 분석하였다.
유산소운동 검사
모든 대상자가 최대운동부하검사를 실시하도록 하여 VO2max를 구하였으며, 이 수치에 근거하여 VO2max의 70%에 해당되는 강도를 산출한 다음, 이 강도에서 30분간 유산소운동을 실시하도록 하면서 안정시와 회복기 중에 주요 종속변인을 측정하였다. 이 과정을 구체적으로 기술하면 다음과 같다.
최대운동부하검사
각 대상자의 유산소운동능력을 측정하기 위하여 본 실험 5일전 최대운동부하검사를 실시하였다. 자동가스분석기(Ultima CPX, Medgraphics, Minneapolis, USA)와 트레드밀을 사용하였고, 대상자의 가슴에 심박수 측정기(RS-400, Polar, Oulu, Finland)를 착용하여 검사 중 HR을 측정하였다. 이 검사에 Bruce protocol을 적용하여 운동 강도를 점증적으로 증가시켜 탈진 상태(all-out)까지 지속시키는 최대운동부하검사를 실시하였다(Bruce et al., 2004). 측정 전 모든 대상자에게 운동 자각도(rating of perceived exertion: RPE)에 대하여 설명하였고, 매 측정 시기에 따라 상태를 확인하였다. 측정 중 대상자가 손을 들어 검사 종료를 원하는 경우 실험을 종료하였다. 이 검사의 성립기준은 1) 운동부하가 증가되어도 산소섭취량과 심박수가 증가되지 않는 경우, 2) 나이에 의거하여 산출된 최대심박수의 90%를 넘는 경우, 3) 호홉교환율(respiratory exchange ratio: RER)이 1.15 이상인 경우, 그리고 4) RPE가 17 이상인 경우 중 3가지 이상을 만족시키는 경우로 하였다(ACSM, 2013).
유산소운동 검사 방법
각 대상자 VO2max 70%의 강도로 30분간 달리기를 실시하도록 하였다. 먼저 VO2max의 70%에 해당되는 달리기 속도를 산출하기 위하여 Janot(2005)이 제시한 다음과 같은 공식을 이용하였다.
⦁Running: VO2(ml·kg-1·min-1) = [0.2ml·kg-1·meter-1 * 속도(m·min-1)] + [0.9ml·kg-1·meter-1 * 속도(m·min-1) * G] +3.5 ml·kg-1·min-1
G = 퍼센트 경사도, 소수점 표현
산출한 속도로 달리게 한 후 자동가스분석기(Ultima CPX, Medgraphics, Minneapolis, USA)를 착용한 상태에서 산소섭취량을 모니터하여 각 대상자의 산소섭취량이 VO2max 70% 수준으로 유지되도록 속도를 조절하였다. Citrulline 처치시와 비처치시 모두 동일한 방법으로 30분간 유산소운동을 실시하도록 하였다.
유산소운동 검사 중 측정 시점
VO2max 70% 강도로 30분간 유산소운동을 한 후 PEH를 검사하기 위하여 MacDonald et al.(2000)이 제시한 시점에서 혈압과 심혈관기능관련 변인을 측정하였다. 유산소운동 전 안정시에 baseline 수치를 측정하였고, VO2max 70%의 30분 운동 후 회복기 5분, 10분, 15분, 30분, 45분, 그리고 60분 시점에서 혈압과 심혈관기능관련 변인을 측정하였다. 아울러 혈중 젖산농도는 안정시 및 회복기 5분, 15분, 그리고 30분 시점에서 측정하였다.
자료처리 방법
이 연구에서 얻는 자료는 SPSS PC⁺ for Windows (version 21.0) 통계 프로그램을 이용하여 분석하였다. 각 변인별로 기술통계량을 제시하기 위해 평균(mean)과 표준편차(standard deviation)를 산출하였다.
두 처치 간, 그리고 각 시기 간 종속변인의 차이를 분석하기 위하여 반복이원변량분석(two-way ANOVA with repeated measures)을 실시하였다. 처치의 주효과, 시기의 주효과, 그리고 처치와 시기의 상호작용이 유의할 경우, 각 시기 간 평균 차이 분석을 위하여 반복이 있는 일원분산분석(one-way ANOVA with repeated measures)을 실시하였고, 각 처치에 따른 유의한 차이가 나타난 경우 사후검증을 위하여 최소유의차 검증법(least significant difference: LSD)을 실시하였다. 두 처치 간 종속변인의의 차이는 종속 t-검증(paired t-test)으로 분석하였다. 모든 통계 분석의 유의수준(a)은 .05의 수준으로 설정하였다.
연구 결과
혈압
안정시와 회복기의 SBP와 DBP
Citrulline 처치와 비처치에 따른 안정시와 회복기 중 SBP와 DBP는 <Table 2>, <Fig. 1>, 그리고 <Fig. 2>에 제시된 바와 같다. 안정시에는 citrulline 처치와 비처치 간에 SBP(P=.357)와 DBP(P=.087) 모두 유의한 차이가 없었다, SBP와 DBP 모두 처치의 주효과, 시기의 주효과, 그리고 처치와 시기의 상호작용이 유의하게 나타났다.
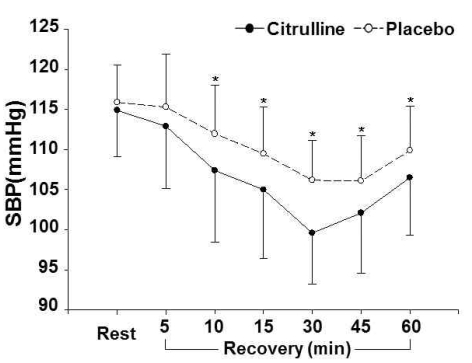
SBP at rest and during recovery phase
(*: significant difference between citrulline and placebo trials)
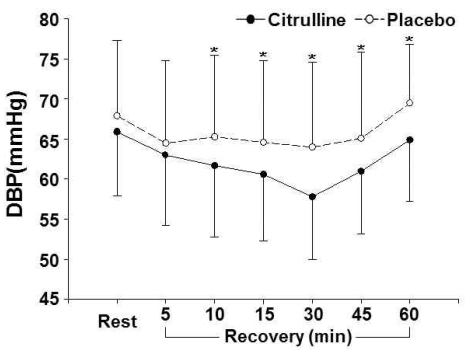
DBP at rest and during recovery phase
(*: significant difference between citrulline and placebo trials)
SBP의 경우 citrulline 처치와 비처치 모두 안정시와 비교하여 회복기 10분, 15분, 30분, 45분, 그리고 60분까지 유의하게 낮은 것으로 나타났다. Citrulline 처치가 비처치와 비교하여 10분, 15분, 30분, 45분, 그리고 60분 시점에서 SBP가 유의하게 낮은 것으로 나타났다. DBP의 경우 citrulline 처치는 안정시와 비교하여 5분, 10분, 15분, 30분, 그리고 45분에서 유의하게 낮은 것으로 나타났고, 비처치는 5분, 10분, 15분, 30분, 그리고 60분 시점에서 유의하게 낮은 것으로 나타났다. Citrulline 처치가 비처치와 비교하여 회복기 10분, 15분, 30분, 45분, 그리고 60분 시점에서 유의하게 낮은 것으로 나타났다.
안정시와 회복기의 MAP와 RPP
Citrulline 처치와 비처치에 따른 안정시와 회복기 중 MAP와 RPP는 <Table 3>에 제시된 바와 같다. 안정시에는 citrulline 처치와 비처치 간에 MAP (P=.061)와 RPP(P=.288) 모두 유의한 차이가 없었다, MAP는 처치의 주효과, 시기의 주효과, 그리고 처치와 시기의 상호작용이 유의하게 나타났고, RPP는 처치의 주효과와 시기의 주효과가 유의하게 나타났다.
MAP의 경우 citrulline 처치는 안정시와 비교하여 회복기 5분, 10분, 15분, 30분, 45분, 그리고 60분까지 유의하게 낮은 것으로 나타났고, 비처치는 5분, 10분, 15분, 30분, 그리고 45분까지 유의하게 낮은 것으로 나타났다. Citrulline 처치가 비처치와 비교하여 회복기 10분, 15분, 30분, 45분, 그리고 60분 시점에서 유의하게 낮은 것으로 나타났다. RPP의 경우 citrulline 처치는 안정시와 비교하여 회복기 5분, 10분, 15분, 그리고 30분까지 유의하게 높은 것으로 나타났으며, 비처치는 5분, 10분, 15분, 30분, 45분, 그리고 60분까지 유의하게 높은 것으로 나타났다. Citrulline 처치가 비처치와 비교하여 회복기 30분과 45분 시점에서 유의하게 낮은 것으로 나타났다.
심혈관기능
안정시와 회복기의 HR과 SV
Citrulline 처치와 비처치에 따른 안정시와 회복기 중 HR과 SV는 <Table 4>에 제시된 바와 같다. 안정시에는 citrulline 처치와 비처치 간에 HR(P=.841)과 SV(P=.873) 모두 유의한 차이가 없었다, HR와 SV 모두 처치의 주효과 및 처치와 시기의 상호작용이 유의하게 나타나지 않았으나, 시기의 주효과가 유의하게 나타났다.
HR의 경우 citrulline 처치와 비처치 모두 안정시와 비교하여 회복기 5분, 10분, 15분, 30분, 45분, 그리고 60분 시점까지 유의한 차이가 나타났으나, 각 시점 내에서 두 처치 간에는 HR의 유의한 차이가 나타나지 않았다. SV의 경우 citrulline 처치는 안정시와 비교하여 회복기 10분, 15분, 30분, 45분, 그리고 60분 시점까지 유의하게 낮은 것으로 나타났고, 비처치는 안정시에 비하여 10분, 15분, 30분, 그리고 45분 시점까지 유의하게 낮은 것으로 나타났다. SV는 회복기 45분과 60분 시점에서 citrulline 처치가 비처치와 비교하여 유의하게 낮은 것으로 나타났다.
안정시와 회복기의 CO와 TPR
Citrulline 처치와 비처치에 따른 안정시와 회복기 중 CO와 TPR은 <Table 5>에 제시된 바와 같다. 안정시에는 citrulline 처치와 비처치 간에 CO(P=.720)와 TPR(P=.674) 모두 유의한 차이가 없었다, CO와 TPR은 처치의 주효과 및 처치와 시기의 상호작용이 유의하게 나타나지 않았으나, 시기의 주효과가 유의하게 나타났다.
CO의 경우 citrulline 처치는 안정시와 비교하여 회복기 5분, 10분, 15분, 30분, 그리고 45분 시점까지 유의하게 높게 나타났고, 비처치는 회복기 5분, 10분, 15분, 30분, 45분, 그리고 60분 시점까지 안정시에 비하여 유의하게 높은 것으로 나타났다. 각 시점 내에서 두 처치 간에는 CO의 유의한 차이가 나타나지 않았다. TPR의 경우 citrulline 처치와 비처치 모두 안정시와 비교하여 회복기 5분, 10분, 15분, 30분, 45분, 그리고 60분까지 유의하게 높게 나타났으나, 각 시점 내에서 두 처치 간에는 TPR의 유의한 차이가 나타나지 않았다.
혈중 젖산농도
Citrulline 처치와 비처치에 따른 안정시와 회복기 중 혈중 젖산농도는 <Table 6>에 제시된 바와 같다. 안정시에는 citrulline 처치와 비처치 간에 혈중 젖산농도의 유의한 차이가 없었다(P=.838), 처치의 주효과 및 처치와 시기의 상호작용이 유의하게 나타나지 않았으나, 시기의 주효과가 유의하게 나타났다.
Citrulline 처치의 경우 안정시와 비교하여 회복기 5분 시점에서 혈중 젖산농도가 유의하게 높은 것으로 나타났고, 비처치의 경우 회복기 5분, 15분, 그리고 30분 시점에서 안정시에 비하여 유의하게 높은 것으로 나타났다. 각 시점 내에서 두 처치 간에는 혈중 젖산농도의 유의한 차이가 나타나지 않았다.
논 의
Citrulline 처치에 따른 혈압의 변화
고혈압과 관련하여 운동과학 분야에서 수행된 연구를 살펴보면, 특별한 약물처방 없이 실시한 일회성 운동과 장기간의 운동 트레이닝이 혈압에 미치는 영향을 규명한 연구가 주를 이루었다(MacDonald et al., 2000; Halliwill et al., 2013). 이 중 운동후 저혈압 반응을 의미하는 PEH는 매우 중요한 주제로 부각되었다. PEH는 일회성 운동 후 회복기 중에 SBP와 DBP가 안정시 수치보다 낮게 지속되는 상태를 의미하며, 이와 같은 PEH가 장기간의 반복적인 운동을 누적되면 안정시 혈압의 감소로 이어져 고혈압의 예방과 개선에 도움을 줄 수 있다(Chobanian et al., 2003).
혈관 이완작용을 하는 citrulline은 일부 사람들의 경우 결핍되어 있는 아미노산인 arginine의 형성을 돕는 기능을 가지고 있으며(Marini et al., 2012), arginine의 가장 중요한 역할 중 하나는 NO를 생성하는 것이다. NO는 많은 생리학적 시스템과 관련되어 있는 세포신호 분자이고, 심혈관계에서는 혈관 저항성(vascular resistance)과 고혈압을 낮추는데 중요한 기능을 한다(Stamler & Meissner, 2001). 이 연구는 PEH의 중요성을 바탕으로 citrulline 섭취가 PEH를 크게 나타나게 하는데 도움을 주는지 여부를 알아보기 위하여 시도되었으며, 이에 따라 운동 후 회복기 중 혈압을 측정하였다. 이 연구에서 citrulline 처치시 회복기 중 SBP와 DBP가 회복기 10분, 15분, 30분, 45분, 그리고 60분 시점에서 비처치에 비하여 유의하게 낮게 나타났다. Citrulline 처치시 SBP가 회복기 10분, 15분, 30분, 45분, 그리고 60분 시점에서 비처치에 비하여 각각 4.6 mmHg, 4.5 mmHg, 6.6 mmHg, 4.0 mmHg, 그리고 3.4 mmHg 낮게 나타났다. Citrulline 처치시 DBP도 같은 시점에서 비처치에 비하여 각각 3.6 mmHg, 4.0 mmHg, 6.2 mmHg, 4.1 mmHg, 그리고 4.5 mmHg 낮게 나타났다.
Figueroa et al.(2012)은 고혈압 전단계인 경계성 고혈압자를 대상으로 citrulline을 하루 6 g씩 6주간 처치한 결과 모든 대상자의 동맥기능이 개선되어 혈압이 낮아졌다고 보고하였다. Orozco et al.(2010)은 심장질환자를 대상으로 arginine 섭취집단은 하루 8 g, 그리고 citrulline 섭취집단은 하루 3 g씩 8주간 섭취시키고 심장초음파검사(echocardiogram)를 실시한 결과, 두 집단 모두 SBP와 DBP 동맥혈압이 유의하게 감소되었으며, 특히 citrulline 섭취집단의 폐동맥혈압이 arginine 섭취집단보다 더 유의하게 감소되었다고 보고하면서, 이는 SBP 폐동맥혈압의 감소에 기인한다고 주장하였다. Ochiai et al.(2012)도 citrulline 섭취로 인한 혈관개선 효과를 보고하였다. 이들은 NO가 혈관기능을 유지하는 데 중요한 역할을 하며, citrulline 섭취에 의한 NO의 증가가 동맥경화의 조절기능 개선과 혈압 감소를 기여했다고 해석하였다. 그러나 NO를 증가시키기 위한 기전에 대한 확실한 설명은 아직까지 미흡한 실정이며, citrulline 섭취를 할 때 운동을 병행하는 것이 NO를 증가시키는데 유리하다는 보고 정도만 도출되었다(Denis et al., 1991; Eto et al., 1994).
운동과 혈압의 관계를 규명한 많은 선행 연구에서 PEH에 대한 관심이 집중되었고, 이와 같은 회복기 중 혈압 감소의 기전도 일부 규명된 상태이다(Beaulieu et al., 1993; Smelker et al., 2004). 이 연구에서도 기존의 관련 선행 연구(Hagberg et al., 1987; Chobanian et al., 2003)와 같이 운동후 회복기 중 PEH 반응이 나타났다. 특히, citrulline 처치시 SBP와 DBP가 모두 비처치보다 유의하게 낮게 나타났다. 이와 관련하여, Moinard et al.(2016)은 단기간의 citrulline 섭취를 통하여 혈장 내 arginine과 NOS (nitric oxide synthase)의 농도가 유의하게 증가되었다고 보고하였다. 이는 NO의 농도와 체내 이용률을 증가시키게 되며, 그 결과 혈관 이완 작용이 활성화 되어 혈압의 감소가 나타난다. 따라서 citrulline 섭취가 NO의 생성을 증가시켜 혈관 이완작용을 활성화 시키는 기전으로 citrulline 섭취를 통하여 PEH가 증가된 현상을 해석할 수 있다.
한편, 이 연구에서 얻은 RPP 결과를 보면 시기의 주효과가 유의하게 나타났으며, citrulline 처치시 비처치와 비교하여 회복기 30분과 45분 시점에서 유의하게 낮게 나타났다. RPP는 심근의 산소소비량을 나타내는 지수로서, 심근에 대한 부담을 평가하는 지표가 되며 심혈관기능과 직접적인 관련이 있다. 이 연구에서 citrulline의 섭취를 통하여 RPP가 유의하게 감소된 것은 혈관 이완작용이 심장기능에 영향을 미친다는 Ochiai et al.(2012)의 보고와 관련 있어 보인다. 또한 Alsop & Hauton(2016)의 연구에서 20대 고혈압 전단계 남성을 대상으로 NO 섭취집단, citrulline 섭취집단, 그리고 통제집단을 비교한 결과 NO 섭취집단과 citrulline 섭취집단의 RPP가 통제집단에 비하여 유의하게 낮게 나타났다. 이와 같은 결과는 citrulline의 섭취를 통하여 말초 혈관이 이완되고 심장기능이 개선된 것을 의미하며, 이를 통하여 혈압이 감소되어 PEH에도 긍정적인 영향을 미친 것으로 해석된다.
이상의 내용을 정리하면, citrulline 섭취가 NO의 생성 중가를 통하여 혈관 이완작용을 강화하고, 결과적으로 운동후 회복기 중 혈압을 더욱 감소시켜 보다 큰 PEH 반응이 나타나게 하였다. 이에 더하여 RPP 또한 낮추는 것으로 보았을 때 심장에 대한 부담을 줄이면서 PEH를 증가시킨다는 점에서 그 가치가 배가된다. 또한 지금까지 수행된 선행 연구에서는 대부분 고혈압환자를 대상으로 하였지만, 이 연구의 대상자는 고혈압 전단계와 정상혈압자를 대상으로 유의한 PEH의 증가를 나타냈다는 점에서 의미가 있다고 판단된다. 향후 경계성 고혈압자 및 고혈압환자를 대상으로 한 연구, 혈중 NO와 관련 효소의 분석을 함께 하여 기전을 보다 명확하게 밝히는 연구, 그리고 장기간의 운동 트레이닝 시 citrulline 섭취 여부가 고혈압환자의 혈압에 미치는 영향을 규명하는 후속 연구가 요청된다.
Citrulline 처치에 따른 심혈관기능의 변화
SBP는 심근탄력성의 예비력을 나타내는 지표가 되며(Kasser & Bruce, 1969),혈압은 CO, TPR, 혈관의 탄성, 그리고 혈액량 등 전반적인 심혈관기능에 의해 결정된다(Kenney et al., 1999). 따라서 운동에 의한 혈압의 변화를 규명하기 위해서는 HR, SV, CO, 그리고 TPR의 변화를 함께 살펴볼 필요가 있다. 그 동안 PEH가 나타나는 기전을 설명하는 몇 가지 가설이 제안되었으며, 그 중 가장 대표적인 가설은 체내 신경자극과 근육신경이 CO와 TPR의 직접적인 영향을 받기 때문에, 동맥혈압이 CO와 TPR의 영향을 받아 결정된다는 것으로 설명된다(Hagberg et al., 1987). Beaulieu et al.(1993)은 고혈압환자를 대상으로 트레드밀에서 간헐적인 최대하운동을 실시한 결과, 운동후 회복기 중 TPR이 안정시에 비해 유의하게 증가되었다고 보고하였다. 따라서 운동후 회복기 중 증가된 TPR은 PEH를 나타내는 중요한 기전 중 하나라고 해석할 수 있다.
이 연구에서는 citrulline 처치와 비처치 간에 회복기 중 HR, CO, 그리고 TPR 모두 유의한 차이가 나타나지 않았다. SV는 citrulline 처치시 회복기 45분과 60분 시점에서 비처치보다 유의하게 낮게 나타났다. Kenney et al.(1999)은 SV가 심장에 돌아오는 정맥혈의 양, 심실의 팽창력, 심실의 수축력, 그리고 대동맥과 폐동맥 압력 등 네 가지 요인의 영향을 받는다고 보고하였다. 이 연구에서 citrulline 처치에 의하여 회복기 중 SV가 낮아진 것은 MAP의 유의한 감소로 설명될 수 있다 즉, citrulline 섭취로 인한 NO의 증가가 혈관 이완작용을 증대시켜 MAP를 유의하게 감소시켰고, 이로 인하여 SV에 영향을 주는 주요 요인 중 하나인 대동맥과 폐동맥 압력에 영향을 주었기 때문인 것으로 판단된다. 한편, 이 연구에서는 citrulline 섭취에 따라 회복기 중 HR의 유의한 감소가 나타나지 않았다. 이는 장기간의 citrulline 섭취가 운동후 HR에 긍정적인 영향을 주었다고 보고한 Nelin & Hoffman(2001)의 연구와 다소 상반되는 것으로서, 이와 같은 차이는 연구 간의 citrulline 섭취기간의 차이에 의하여 나타난 것으로 해석된다.
이 연구에서 citrulline 섭취에 따라 회복기 중 혈압이 유의하게 감소된 것으로 나타났지만, 실혈관기능 지표 중 SV만 일부 영향을 받았을 뿐 HR, CO, 그리고 TPR의 유의한 변화는 나타나지 않았다. 따라서 citrulline 섭취에 의한 운동후 회복기 중 혈압의 감소 반응을 심혈관기능의 변화로 설명하기에는 무리가 있어 보인다. 따라서 기전을 밝히기 위하여 필요한 혈중 NO와 관련 효소의 변화를 규명하는 연구, 그리고 보다 장기간의 citrulline 섭취가 심혈관 기능에 미치는 영향을 규명하는 후속 연구가 요청된다.
Citrulline 처치에 따른 혈중 젖산농도의 변화
무산소성 해당작용의 최종 부산물인 젖산은 피로를 유발하고, 운동능력에 부정적인 영향을 미치는 것으로 보고되었으나(Sahlin, 1992), 에너지원로서의 가치도 가지고 있는 것으로 알려져 있다. Brooks & Cassens(1973)는 운동후 젖산의 대사경로가 크렙스 회로에 가까이 있어 젖산이 유산소 대사경로에도 활용되며, 글루코스 신생합성(gluconeogenesis)의 전구체로서 활용되기도 한다고 보고하였다. 이와 관련하여 Miller et al.(2002)은 젖산이 에너지대사 과정에서 선호되는 연료로서 피루브산의 전환되며, 피루브산의 증가는 포도당의 필요성을 감소시켜 결과적으로 산소요구량의 감소로 이어질 수 있다고 주장하였다.
운동 중 AMP가 IMP로 전환되며 아민기가 제거될 때 혈중 암모니아 수치가 증가되며, 이것이 피로의 한 원인으로 제기되었다(Barnes et al., 1964). Wilkerson & Horvath(1975)는 최대운동부하검사를 실시한 후 혈중 암모니아 수치가 안정시에 비하여 1.8배 증가되었다고 보고하였다. 고강도 운동을 통하여 체내 암모니아의 수치가 증가되면 phosphofructokinase (PFK)가 활성화하고, 피루브산이 아세틸 CoA로 산화하는 것이 억제된다. PFK의 활성화는 젖산의 생성량을 증가시키고 세포내 PH를 감소시키며 근소포체(sarcoplasmic reticulum)로 부터 칼슘 이온의 방출량을 감소시키며, 피루브산 산화의 억제는 골격근으로 ATP가 공급되는 양을 감소시킨다. 따라서 체내 암모니아의 축적은 운동능력을 약화시키며, urea cycle은 간에서 암모니아를 요소로 변환시키므로 운동능력 향상에 중요한 요소로 인식되어 왔다(Hirai et al., 1995).
Citrulline은 urea cycle의 구성요소로서 암모니아 제거자로서 주목을 받아왔다. 즉, citrulline의 섭취는 혈중 암모니아의 생성을 줄이고, 나아가서 혈중 젖산농도를 감소시키며, 운동능력의 개선에도 공헌할 것으로 기대된다. 이에 관련하여 Takeda et al.(2011)은 citrulline의 섭취가 운동능력을 개선시키고, 혈중 젖산농도의 수치를 유의하게 감소시켰다고 보고하였다. 이와 같은 운동능력의 개선과 젖산 분해능력의 향상은 urea cycle의 미토콘드리아의 기질 반응과 관련이 있다. 미토콘드리아 내부에서 암모니아와 중탄산염(HCO3-)의 결합으로 인한 citrulline의 증가와 citrulline의 섭취가 체내의 citrulline 양을 증가시켜 결과적으로 미토콘드리아에 긍정적인 영향을 주는 것이다(El-Hattab et al., 2012). 그러나 이 연구에서는 citrulline 처치와 비처치 간에 혈중 젖산농도의 통계적으로 유의한 차이가 나타나지 않았다. 향후 대상자 수를 늘리고, citrulline 섭취의 기간을 길게 적용하여 연구를 하면 citrulline 섭취가 운동후 혈중 젖산농도에 미치는 영향을 보다 명확하게 규명할 수 있을 것이라고 판단된다.
결 론
이 연구의 목적은 고혈압 전단계와 정상혈압 범주의 20대 남성을 대상으로 citrulline 섭취가 일회성 유산소운동후 혈압, 심혈관기능, 그리고 혈중 젖산농도에 미치는 영향을 규명하는 것이었다. 각각 4일간의 citrulline 처치와 placebo 처치(비처치)가 안정시와 VO2max 70% 강도로 30분간 실시한 유산소운동 후 회복기 중 혈압, 심혈관기능, 그리고 혈중 젖산농도에 미치는 영향을 분석하였다. 이 연구의 주요 결과를 요약하여 기술하면 다음과 같다.
1. Citrulline 처치를 한 경우 회복기 10~60분 시점에서 SBP와 DBP, 그리고 MAP가 비처치에 비하여 유의하게 낮게 나타났으며, RPP는 citrulline 처치가 비처치에 비하여 회복기 30분과 45분 시점에서 유의하게 낮은 것으로 나타났다.
2. Citrulline 처치와 비처치 간에 안정시와 회복기 중 SV를 제외한 HR, CO, 그리고 TPR은 유의한 차이가 나타나지 않았다.
3. Citrulline 처치와 비처치 간에 안정시와 회복기 중 혈중 젖산농도는 유의한 차이가 나타나지 않았다.
이상의 결과를 종합해 보면, citrulline 처치가 비처치에 비하여 PEH 반응을 더욱 크게 나타나도록 하였으며, citrulline 처치가 혈압만 낮출 뿐 심장에 대한 부담 또는 기타 심혈관계 반응에는 큰 영향을 미치지 않는 것으로 나타났다. 즉, 단기간의 citrulline 섭취는 심장에 부담을 주지 않으면서 PEH 반응을 더 크게 하는 효과적인 처치라고 결론지을 수 있다. 향후 고혈압환자를 대상으로 하는 후속 연구가 요청되며, 장기간의 citrulline을 섭취하면서 운동 트레이닝을 할 경우 큰 PEH 누적으로 인하여 고혈압에 긍정적인 효과가 나타날 것으로 판단된다. 향후 고혈압환자를 대상으로 운동 트레이닝의 혈압감소 효과를 검증하는 과정에서 citrulline 섭취 여부에 따른 효과를 규명하는 연구가 요청된다.
References
Alsop, P. & Hauton, D.(2016). Oral nitrate and citrulline decrease blood pressure and increase vascular conductance in young adults: a potential therapy for heart failure. European Journal of Applied Physiology, 116(9), 1651-1661.
Alsop P., et al, Hauton D.. 2016;Oral nitrate and citrulline decrease blood pressure and increase vascular conductance in young adults: a potential therapy for heart failure. European Journal of Applied Physiology 116(9):1651–1661. 10.1007/s00421-016-3418-7.American College of Sports Medicine(2013). ACSM's Resource for Guidelines for Exercise Testing and Prescription.Lippincott Williams & Wilkins: Philadelphia, PA.
American College of Sports Medicine. 2013. ACSM's Resource for Guidelines for Exercise Testing and Prescription Lippincott Williams & Wilkins: Philadelphia, PA.Arakawa, K., Miura, S. I., Koga, M., Kinoshita, A., Urata, H., & Kiyonaga, A.(1995). Activation of renal dopamine system by physical exercise. Hypertension Research, 18(Suppl.), S73-S77.
Arakawa K., Miura S. I., Koga M., Kinoshita A., Urata H., et al, Kiyonaga A.. 1995;Activation of renal dopamine system by physical exercise. Hypertension Research 18(Suppl):S73–S77. 10.1291/hypres.18.supplementi_s73.Barnes, R. H., Labadan, B. A., Siyamoglu, B., & Bradfield, R. B.(1964). Effects of exercise and administration of aspartic acid on blood ammonia in the rat. American Journal of Physiology, 207(6), 1242-1246.
Barnes R. H., Labadan B. A., Siyamoglu B., et al, Bradfield R. B.. 1964;Effects of exercise and administration of aspartic acid on blood ammonia in the rat. American Journal of Physiology 207(6):1242–1246. 10.1152/ajplegacy.1964.207.6.1242.Beaulieu, M., Nadeau, A., Lacourcière, Y., & Cléroux, J.(1993). Post exercise reduction in blood pressure in hypertensive subjects: effects of angiotensin converting enzyme inhibition. British Journal of Clinical Pharmacology, 36(4), 331-338.
Beaulieu M., Nadeau A., Lacourcière Y., et al, Cléroux J.. 1993;Post exercise reduction in blood pressure in hypertensive subjects: effects of angiotensin converting enzyme inhibition. British Journal of Clinical Pharmacology 36(4):331–338. 10.1111/j.1365-2125.1993.tb00372.x.Bendahan, D., Mattei, J. P., Ghattas, B., Confort-Gouny, S., Le Guern, M. E., & Cozzone, P. J.(2002). Citrulline/malate promotes aerobic energy production in human exercising muscle. British Journal of Sports Medicine, 36(4), 282-289.
Bendahan D., Mattei J. P., Ghattas B., Confort-Gouny S., Le Guern M. E., et al, Cozzone P. J.. 2002;Citrulline/malate promotes aerobic energy production in human exercising muscle. British Journal of Sports Medicine 36(4):282–289. 10.1136/bjsm.36.4.282.Boger, R. H.(2008). L-Arginine therapy in cardiovascular pathologies: beneficial or dangerous? Current Opinion in Clinical Nutrition & Metabolic Care, 11(1), 55-61.
Boger R. H.. 2008;L-Arginine therapy in cardiovascular pathologies: beneficial or dangerous? Current Opinion in Clinical Nutrition & Metabolic Care 11(1):55–61.Boone, Jr, J. B., Levine, M. A. R. C., Flynn, M. G., Pizza, F. X., Kubitz, E. R., & Andres, F. F.(1992). Opioid receptor modulation of postexercise hypotension. Medicine and Science in Sports and Exercise, 24(10), 1108-1113.
Boone, Jr J. B., Levine M. A. R. C., Flynn M. G., Pizza F. X., Kubitz E. R., et al, Andres F. F.. 1992;Opioid receptor modulation of postexercise hypotension. Medicine and Science in Sports and Exercise 24(10):1108–1113.Brooks, G. A., Brauner, K. E., & Cassens, R. G.(1973). Glycogen synthesis and metabolism of lactic acid after exercise. American Journal of Physiology, 224(5), 1162-6.
Brooks G. A., Brauner K. E., et al, Cassens R. G.. 1973;Glycogen synthesis and metabolism of lactic acid after exercise. American Journal of Physiology 224(5):1162–6. 10.1152/ajplegacy.1973.224.5.1162.Bruce, R. A., Blackmon, J. R., Jones, J. W., & Strait, G.(2004). Exercising testing in adult normal subjects and cardiac patients. Annals of Noninvasive Electrocardiology, 9(3), 291-303.
Bruce R. A., Blackmon J. R., Jones J. W., et al, Strait G.. 2004;Exercising testing in adult normal subjects and cardiac patients. Annals of Noninvasive Electrocardiology 9(3):291–303. 10.1111/j.1542-474x.2004.93003.x.Burt, V. L., Cutler, J. A., Higgins, M., Horan, M. J., Labarthe, D., Whelton, P., & Roccella, E. J.(1995). Trends in the prevalence, awareness, treatment, and control of hypertension in the adult US population data from the health examination surveys, 1960 to 1991. Hypertension, 26(1), 60-69.
Burt V. L., Cutler J. A., Higgins M., Horan M. J., Labarthe D., Whelton P., et al, Roccella E. J.. 1995;Trends in the prevalence, awareness, treatment, and control of hypertension in the adult US population data from the health examination surveys, 1960 to 1991. Hypertension 26(1):60–69.Chobanian, A. V., Bakris, G. L., Black, H. R., Cushman, W. C., Green, L. A., Izzo, J. L., Jones, D. W., Materson, B. J., Oparil, S., Wright, J. T., & Roccella, E. J.(2003). Seventh report of the joint national committee on prevention, detection, evaluation, and treatment of high blood pressure. Hypertension, 42(6), 1206-1252.
Chobanian A. V., Bakris G. L., Black H. R., Cushman W. C., Green L. A., Izzo J. L., Jones D. W., Materson B. J., Oparil S., Wright J. T., et al, Roccella E. J.. 2003;Seventh report of the joint national committee on prevention, detection, evaluation, and treatment of high blood pressure. Hypertension 42(6):1206–1252. 10.1161/01.hyp.0000107251.49515.c2.Cleroux, J. E. A. N., Kouamé, N., Nadeau, A. N. D. R. E., Coulombe, D. E. N. I. S., & Lacourciere, Y. V. E. S.(1992). Baroreflex regulation of forearm vascular resistance after exercise in hypertensive and normotensive humans. American Journal of Physiology-Heart and Circulatory Physiology, 263(5), H1523-H1531.
Cleroux J. E. A. N., Kouamé N., Nadeau A. N. D. R. E., Coulombe D. E. N. I. S., et al, Lacourciere Y. V. E. S.. 1992;Baroreflex regulation of forearm vascular resistance after exercise in hypertensive and normotensive humans. American Journal of Physiology-Heart and Circulatory Physiology 263(5):H1523–H1531. 10.1152/ajpheart.1992.263.5.h1523.Curis, E., Nicolis, I., Moinard, C., Osowska, S., Zerrouk, N., Bénazeth, S., & Cynober, L.(2005). Almost all about citrulline in mammals. Amino Acids, 29(3), 177-205.
Curis E., Nicolis I., Moinard C., Osowska S., Zerrouk N., Bénazeth S., et al, Cynober L.. 2005;Almost all about citrulline in mammals. Amino Acids 29(3):177–205. 10.1007/s00726-005-0235-4.Denis, C., Dormois, D., Linossier, M. T., Eychenne, J. L., Hauseux, P., & Lacour, J. R.(1991). Effect of arginine aspartate on the exercise-induced hyperammoniemia in humans: a two periods cross-over trial. Archives Internationales de Physiologie, de Biochimie et de Biophysique, 99(1), 123-127.
Denis C., Dormois D., Linossier M. T., Eychenne J. L., Hauseux P., et al, Lacour J. R.. 1991;Effect of arginine aspartate on the exercise-induced hyperammoniemia in humans: a two periods cross-over trial. Archives Internationales de Physiologie, de Biochimie et de Biophysique 99(1):123–127. 10.3109/13813459109145914.El-Hattab, A. W., Emrick, L. T., Craigen, W. J., & Scaglia, F.(2012). Citrulline and arginine utility in treating nitric oxide deficiency in mitochondrial disorders. Molecular Genetics and Metabolism, 107(3), 247-252.
El-Hattab A. W., Emrick L. T., Craigen W. J., et al, Scaglia F.. 2012;Citrulline and arginine utility in treating nitric oxide deficiency in mitochondrial disorders. Molecular Genetics and Metabolism 107(3):247–252. 10.1016/j.ymgme.2012.06.018.Eto, B., Peres, G., & Moel, G. L.(1994). Effects of an ingested glutamate arginine salt on ammonemia during and after long lasting cycling. Archives Internationales de Physiologie, de Biochimie et de Biophysique, 102(3), 161-162.
Eto B., Peres G., et al, Moel G. L.. 1994;Effects of an ingested glutamate arginine salt on ammonemia during and after long lasting cycling. Archives Internationales de Physiologie, de Biochimie et de Biophysique 102(3):161–162. 10.3109/13813459409007530.Figueroa, A., Sanchez-Gonzalez, M. A., Wong, A., & Arjmandi, B. H.(2012). Watermelon extract supplementation reduces ankle blood pressure and carotid augmentation index in obese adults with prehypertension or hypertension. American Journal of Hypertension, 25(6), 640-643.
Figueroa A., Sanchez-Gonzalez M. A., Wong A., et al, Arjmandi B. H.. 2012;Watermelon extract supplementation reduces ankle blood pressure and carotid augmentation index in obese adults with prehypertension or hypertension. American Journal of Hypertension 25(6):640–643. 10.1038/ajh.2012.20.Figueroa, A., Wong, A., & Kalfon, R.(2014). Effects of watermelon supplementation on aortic hemodynamic responses to the cold pressor test in obese hypertensive adults. American Journal of Hypertension, 27(7), 899-906.
Figueroa A., Wong A., et al, Kalfon R.. 2014;Effects of watermelon supplementation on aortic hemodynamic responses to the cold pressor test in obese hypertensive adults. American Journal of Hypertension 27(7):899–906. 10.1093/ajh/hpt295.Giannesini, B., Izquierdo, M., Le Fur, Y., Cozzone, P. J., Verleye, M., Le Guern, M. E., Gillardin, J. M., & Bendahan, D.(2009). Beneficial effects of citrulline malate on skeletal muscle function in endotoxemic rat. European Journal of Pharmacology, 602(1), 143-147.
Giannesini B., Izquierdo M., Le Fur Y., Cozzone P. J., Verleye M., Le Guern M. E., Gillardin J. M., et al, Bendahan D.. 2009;Beneficial effects of citrulline malate on skeletal muscle function in endotoxemic rat. European Journal of Pharmacology 602(1):143–147. 10.1016/j.ejphar.2008.11.015.Hagberg, J. M., Montain, S. J., & Martin, W. H.(1987). Blood pressure and hemodynamic responses after exercise in older hypertensives. Journal of Applied Physiology, 63(1), 270-276.
Hagberg J. M., Montain S. J., et al, Martin W. H.. 1987;Blood pressure and hemodynamic responses after exercise in older hypertensives. Journal of Applied Physiology 63(1):270–276. 10.1152/jappl.1987.63.1.270.Halliwill, J. R., Buck, T. M., Lacewell, A. N., & Romero, S. A.(2013). Postexercise hypotension and sustained postexercise vasodilatation: what happens after we exercise?. Experimental Physiology, 98(1), 7-18.
Halliwill J. R., Buck T. M., Lacewell A. N., et al, Romero S. A.. 2013;Postexercise hypotension and sustained postexercise vasodilatation: what happens after we exercise? Experimental Physiology 98(1):7–18. 10.1113/expphysiol.2011.058065.Hickner, R. C., Tanner, C. J., Evans, C. A., Clark, P. D., Haddock, A., Fortune, C., Geddis, H., Waugh, W., & Mccammon, M.(2006). L-citrulline reduces time to exhaustion and insulin response to a graded exercise test. Medicine and Science in Sports and Exercise, 38(4), 660-666.
Hickner R. C., Tanner C. J., Evans C. A., Clark P. D., Haddock A., Fortune C., Geddis H., Waugh W., et al, Mccammon M.. 2006;L-citrulline reduces time to exhaustion and insulin response to a graded exercise test. Medicine and Science in Sports and Exercise 38(4):660–666. 10.1249/01.mss.0000210197.02576.da.Hirai, T., Minatogawa, Y., Hassan, A. M., & Kido, R.(1995). Metabolic inter-organ relations by exercise of fed rat: carbohydrates, ketone body, and nitrogen compounds in splanchnic vessels. Physiology and Behavior, 57(3), 515-522.
Hirai T., Minatogawa Y., Hassan A. M., et al, Kido R.. 1995;Metabolic inter-organ relations by exercise of fed rat: carbohydrates, ketone body, and nitrogen compounds in splanchnic vessels. Physiology and Behavior 57(3):515–522. 10.1016/0031-9384(94)00293-e.Janot, J. M.(2005). Calculating Caloric Expenditure. IDEA Fitness Journal, 2(6), 32-33.
Janot J. M.. 2005;Calculating Caloric Expenditure. IDEA Fitness Journal 2(6):32–33.Kashani, B. S., Pour, P. T., Malekmohammad, M., Behzadnia, N., Sheybani-Afshar, F., Fakhri, M., Chaibakhsh, S., Naghashzadeh, F., & Aidenlou, S.(2014). Oral l-citrulline malate in patients with idiopathic pulmonary arterial hypertension and Eisenmenger Syndrome: A clinical trial. Journal of Cardiology, 64(3), 231-235.
Kashani B. S., Pour P. T., Malekmohammad M., Behzadnia N., Sheybani-Afshar F., Fakhri M., Chaibakhsh S., Naghashzadeh F., et al, Aidenlou S.. 2014;Oral l-citrulline malate in patients with idiopathic pulmonary arterial hypertension and Eisenmenger Syndrome: A clinical trial. Journal of Cardiology 64(3):231–235.Kasser, I. S. & Bruce, R. A.(1969). Comparative effects of aging and coronary heart disease on submaximal and maximal exercise. Circulation, 39(6), 759-774.
Kasser I. S., et al, Bruce R. A.. 1969;Comparative effects of aging and coronary heart disease on submaximal and maximal exercise. Circulation 39(6):759–774. 10.1161/01.cir.39.6.759.Kenney, W. L., Wilmore, J., & Costill, D.(1999). Physiology of Sport and Exercise, 5th ed.Human Kinetics: Champaign, IL.
Kenney W. L., Wilmore J., et al, Costill D.. 1999. Physiology of Sport and Exercise 5th edth ed. Human Kinetics: Champaign, IL.Kiviniemi, A. M., Hautala, A. J., Karjalainen, J. J., Piira, O. P., Lepojärvi, S., Ukkola, O., Huikuri, H. V., & Tulppo, M. P.(2014). Acute post-exercise change in blood pressure and exercise training response in patients with coronary artery disease. Frontiers in Physiology, 5, 526-533.
Kiviniemi A. M., Hautala A. J., Karjalainen J. J., Piira O. P., Lepojärvi S., Ukkola O., Huikuri H. V., et al, Tulppo M. P.. 2014;Acute post-exercise change in blood pressure and exercise training response in patients with coronary artery disease. Frontiers in Physiology 5:526–533.Lomonosova, Y. N., Kalamkarov, G. R., Bugrova, A. E., Shevchenko, T. F., Kartashkina, N. L., Lysenko, E. A., Shvets, V. I., & Nemirovskaya, T. L.(2011). Protective effect of L-arginine administration on proteins of unloaded m. soleus. Biochemistry (Moscow), 76(5), 571-580.
Lomonosova Y. N., Kalamkarov G. R., Bugrova A. E., Shevchenko T. F., Kartashkina N. L., Lysenko E. A., Shvets V. I., et al, Nemirovskaya T. L.. 2011;Protective effect of L-arginine administration on proteins of unloaded m. soleus. Biochemistry (Moscow) 76(5):571–580. 10.1134/s0006297911050075.MacDonald, J. R., MacDougall, J. D., & Hogben, C. D.(1999). The effects of exercise intensity on post exercise hypotension. Journal of Human Hypertension, 13(8), 527-531.
MacDonald J. R., MacDougall J. D., et al, Hogben C. D.. 1999;The effects of exercise intensity on post exercise hypotension. Journal of Human Hypertension 13(8):527–531. 10.1038/sj.jhh.1000866.MacDonald, J. R., MacDougall, J. D., & Hogben, C. D.(2000). The effects of exercise duration on post-exercise hypotension. Journal of Human Hypertension, 14(2), 125-129.
MacDonald J. R., MacDougall J. D., et al, Hogben C. D.. 2000;The effects of exercise duration on post-exercise hypotension. Journal of Human Hypertension 14(2):125–129. 10.1038/sj.jhh.1000953.Mandel, H., Levy, N., Izkovitch, S., & Korman, S. H.(2005). Elevated plasma citrulline and arginine due to consumption of Citrullus vulgaris(watermelon). Journal of Inherited Metabolic Disease, 28(4), 467-472.
Mandel H., Levy N., Izkovitch S., et al, Korman S. H.. 2005;Elevated plasma citrulline and arginine due to consumption of Citrullus vulgaris(watermelon). Journal of Inherited Metabolic Disease 28(4):467–472.Marini, J. C.(2012). Arginine and ornithine are the main precursors for citrulline synthesis in mice. The Journal of Nutrition, 142(3), 572-580.
Marini J. C.. 2012;Arginine and ornithine are the main precursors for citrulline synthesis in mice. The Journal of Nutrition 142(3):572–580. 10.3945/jn.111.153825.Miller, B. F., Fattor, J. A., Jacobs, K. A., Horning, M. A., Navazio, F., Lindinger, M. I., & Brooks, G. A.(2002). Lactate and glucose interactions during rest and exercise in men: effect of exogenous lactate infusion. The Journal of Physiology, 544(3), 963-975.
Miller B. F., Fattor J. A., Jacobs K. A., Horning M. A., Navazio F., Lindinger M. I., et al, Brooks G. A.. 2002;Lactate and glucose interactions during rest and exercise in men: effect of exogenous lactate infusion. The Journal of Physiology 544(3):963–975. 10.1113/jphysiol.2002.027128.Mohrman, D. E. & Regal, R. R.(1988). Relation of blood flow to VO2, PO2, and PCO2in dog gastrocnemius muscle. American Journal of Physiology-Heart and Circulatory Physiology, 255(5), H1004-H1010.
Mohrman D. E., et al, Regal R. R.. 1988;Relation of blood flow to VO2, PO2, and PCO2in dog gastrocnemius muscle. American. Journal of Physiology-Heart and Circulatory Physiology 255(5):H1004–H1010.Moinard, C., Maccario, J., Walrand, S., Lasserre, V., Marc, J., Boirie, Y., & Cynober, L.(2016). Arginine behaviour after arginine or citrulline administration in older subjects. British Journal of Nutrition, 115(03), 399-404.
Moinard C., Maccario J., Walrand S., Lasserre V., Marc J., Boirie Y., et al, Cynober L.. 2016;Arginine behaviour after arginine or citrulline administration in older subjects. British Journal of Nutrition 115(03):399–404. 10.1017/s0007114515004638.Nelin, L. D. & Hoffman, G. M.(2001). L-arginine infusion lowers blood pressure in children. The Journal of Pediatrics, 139(5), 747-749.
Nelin L. D., et al, Hoffman G. M.. 2001;L-arginine infusion lowers blood pressure in children. The Journal of Pediatrics 139(5):747–749. 10.1067/mpd.2001.118888.Ochiai, M., Hayashi, T., Morita, M., Ina, K., Maeda, M., Watanabe, F., & Morishita, K.(2012). Short-term effects of L-citrulline supplementation on arterial stiffness in middle-aged men. International Journal of Cardiology, 155(2), 257-261.
Ochiai M., Hayashi T., Morita M., Ina K., Maeda M., Watanabe F., et al, Morishita K.. 2012;Short-term effects of L-citrulline supplementation on arterial stiffness in middle-aged men. International Journal of Cardiology 155(2):257–261. 10.1016/j.ijcard.2010.10.004.Orozco-Gutiérrez, J. J., Castillo-Martínez, L., Orea-Tejeda, A., Vázquez-Díaz, O., Valdespino-Trejo, A., Narváez-David, R., Keirns-Davis, C., Carrasco-Ortiz, O., Navarro-Navaroo, A., & Sánchez-Santillán, R.(2010). Effect of L-arginine or L-citrulline oral supplementation on blood pressure and right ventricular function in heart failure patients with preserved ejection fraction. Cardiology Journal, 17(6), 612-618.
Orozco-Gutiérrez J. J., Castillo-Martínez L., Orea-Tejeda A., Vázquez-Díaz O., Valdespino-Trejo A., Narváez-David R., Keirns-Davis C., Carrasco-Ortiz O., Navarro-Navaroo A., et al, Sánchez-Santillán R.. 2010;Effect of L-arginine or L-citrulline oral supplementation on blood pressure and right ventricular function in heart failure patients with preserved ejection fraction. Cardiology Journal 17(6):612–618.Sahlin, K.(1992). Metabolic factors in fatigue. Sports Medicine, 13(2), 99-107.
Sahlin K.. 1992;Metabolic factors in fatigue. Sports Medicine 13(2):99–107.Schwedhelm, E., Maas, R., Freese, R., Jung, D., Lukacs, Z., Jambrecina, A. Böger, R. H.(2008). Pharmacokinetic and pharmacodynamic properties of oral L-citrulline and L-arginine: impact on nitric oxide metabolism. British Journal of Clinical Pharmacology, 65(1), 51-59.
Schwedhelm E., Maas R., Freese R., Jung D., Lukacs Z., Jambrecina A., Böger R. H.. 2008;Pharmacokinetic and pharmacodynamic properties of oral L-citrulline and L-arginine: impact on nitric oxide metabolism. British Journal of Clinical Pharmacology 65(1):51–59. 10.1111/j.1365-2125.2007.02990.x.Seals, D. R., Rogers, M. A., Hagberg, J. M., Yamamoto, C., Cryer, P. E., & Ehsani, A. A.(1988). Left ventricular dysfunction after prolonged strenuous exercise in healthy subjects. The American journal of cardiology, 61(11), 875-879.
Seals D. R., Rogers M. A., Hagberg J. M., Yamamoto C., Cryer P. E., et al, Ehsani A. A.. 1988;Left ventricular dysfunction after prolonged strenuous exercise in healthy subjects. The American journal of cardiology 61(11):875–879. 10.1016/0002-9149(88)90362-1.Smelker, C. L., Foster, C., Maher, M. A., Martinez, R., & Porcari, J. P. (2004). Effect of exercise intensity on postexercise hypotension. Journal of Cardiopulmonary Rehabilitation and Prevention, 24(4), 269-273.
Smelker C. L., Foster C., Maher M. A., Martinez R., et al, Porcari J. P.. 2004;Effect of exercise intensity on postexercise hypotension. Journal of Cardiopulmonary Rehabilitation and Prevention 24(4):269–273. 10.1097/00008483-200407000-00012.Stamler, J. S. & Meissner, G.(2001). Physiology of nitric oxide in skeletal muscle. Physiological Reviews, 81(1), 209-237.
Stamler J. S., et al, Meissner G.. 2001;Physiology of nitric oxide in skeletal muscle. Physiological Reviews 81(1):209–237.Takeda, K., Machida, M., Kohara, A., Omi, N., & Takemasa, T.(2011). Effects of citrulline supplementation on fatigue and exercise performance in mice. Journal of Nutritional Science and Vitaminology, 57(3), 246-250.
Takeda K., Machida M., Kohara A., Omi N., et al, Takemasa T.. 2011;Effects of citrulline supplementation on fatigue and exercise performance in mice. Journal of Nutritional Science and Vitaminology 57(3):246–250. 10.3177/jnsv.57.246.Wilkerson, J. E., Batterton, D. L., & Horvath, S. M.(1975). Ammonia production following maximal exercise: treadmill vs. bicycle testing. European Journal of Applied Physiology and Occupational Physiology, 34(1), 169-172.
Wilkerson J. E., Batterton D. L., et al, Horvath S. M.. 1975;Ammonia production following maximal exercise: treadmill vs. bicycle testing. European Journal of Applied Physiology and Occupational Physiology 34(1):169–172. 10.1007/bf00999929.World Health Organization(2013). A Global Brief on Hypertension.
World Health Organization. 2013; A Global Brief on Hypertension




