평압·저산소 환경에서 스프린트 인터벌 훈련이 혈액학적 변인 및 유·무산소성 운동 능력에 미치는 영향
Effects of Sprint Interval Training on Blood Variables, Aerobic and Anaerobic Performance in Normobaric Hypoxia
Article information
Abstract
본 연구에서는 4주 동안 엘리트 수준의 테니스 선수들을 대상으로 간헐적인 저산소 훈련 및 노출을 병행하는 연구를 진행하였다. 실험집단인 SITH(SIT with Hypoxic)는 2,500-4,000m까지 점진적으로 매주 500m씩 고도를 상승하여 주당 5회, 하루 2회씩 4주 동안 저산소 챔버(simulated nomobaric hypoxic)에서 SIT(sprint interval training)와 3시간의 노출을 병행하였다. 통제집단인 CON(control)은 동일한 기간과 방법으로 저산소 노출 없이 해수면 환경에서 SIT만 실시하였다. 그 결과 산소운반관련 혈액변인들인 Hb와 Hct가 SITH 집단에서 Pre 때와 비교하여 처치 종료 시점인 4,000m(4주차)에서 각각 유의하게 증가하였다(p<.05, p<.01). 유산소성 운동능력 관련 변인들에서는 SITH 집단에서 운동 지속시간(Time)이 4,000m 때에 유의하게 증가하였다(p<.05). 무산소성 운동능력 관련 변인들에서는 PP(W)가 두 집단 모두 4,000m에서 유의하게 증가하였으며(p<.05), PP(W/kg)는 동일한 시점의 고도에서 CON 집단에서는 증가한 경향을, SITH 집단은 3,500m(3주차)와 4,000m에서 각각 유의하게 증가하였다(p<.05). 따라서 본 연구와 유사한 선행 연구들과 달리 간헐적인 저산소 처치와 고강도 훈련과의 접목에 따른 긍정적인 가능성들을 얻음으로서 후속연구에 기여할 가치가 높다고 생각된다.
Trans Abstract
In this study, hypoxic exposure and training with regard to the current progress during the various models 'live and/or sleep high: train high' by way of 4 weeks in elite level tennis players. The experimental group which SITH(SIT with hypoxic) a 2,500m-4,000m to the graded elevation every 500m increased by the week five times a day, two times four weeks treated to a SIT (sprint interval training) and three hours of exposure in hypoxic chamber(simulated normobaric hypoxic). The CON(control) was conducted same period and methods without exposure to hypoxia that a SIT at sea level. As a results, the haematological variables were Hb and Hct compared Pre with the treatment at the end of 4,000 m(at 4 weeks) has been shown to significantly increased in both groups respectively(p<.05, p<.01; vs. Pre). Aerobic exercise capacity related variables that Time was SITH has been shown to significantly increased at 4,000 m(p<.05; vs. Pre). Also, VO2max was SITH has been showed increased in the same period a tendency(p=.072). Anaerobic exercise capacity related variables that PP(W) was both groups increased significantly at 4,000 m(p<.05; vs. Pre), and PP(W/kg) was CON group has been showed increased in the same altitude a tendency, whereas SITH group has been showed increased at 3,500m and 4,000m respectively(p<.05; vs. Pre). Therefore, this study was unlike previous studies with similar positive results as a follow-up study will be contribute to the attainment of a higher value.
서 론
현재까지 엘리트 선수들의 유산소성 운동능력을 효율적으로 향상 시킬 수 있도록 다양한 훈련방법들이 보고 되어왔다. 그 중 Burgomaster et al.(2005)의 연구에 의하면, 비훈련자들에게 윈게이트 테스트의 형태로 높은 강도의 스프린트 인터벌 트레이닝(sprint interval training, SIT)을 단 2주 동안 6번 시행하였는데도 최대산소섭취량(VO2max)의 증가 없이 운동지속시간이 약 2배 증가하는 결과를 가져왔다. 즉, 단기간의 SIT 형태의 훈련 역시 지구력을 향상시킬 수 있다는 가설이 가능하며, 유산소성 운동능력을 증가시키기 위해서는 이러한 SIT형태의 훈련방법이 장기간의 지구력 훈련의 대안이 될 수 있다.
이에 따른 후속연구로서 Burgomaster et al.(2006)의 또 다른 연구에서는 비훈련자들이 2주 동안 매일 스프린트 형태로 훈련을 실시하여 유산소성 능력의 지표효소(marker enzyme) 등의 활동성이 증가됨을 볼 수 있었고 Spina et al.(1996)의 연구에서도 2주간 고강도의 유산소성 지구력 훈련을 통하여 지구력 훈련의 전형적인 결과로서 나타나는 생화학적인 변화를 이끌며 지구력이 증가되는 결과를 얻었다. 이와 같이 SIT는 골격근에서 ADP/AMP 비율에 따라 AMPK와 p38 MAPK의 인산화 반응으로 PGC-1a(Peroxisome proliferator-activated receptor gamma coactivator 1-a)의 활성을 자극하게 된다(Catillo-Quan, 2012). 결국 활성화된 PGC-1a는 전사되어 미토콘드리아 생합성, 혈관신생, 글리코겐 및 지방산화 등을 촉진하여 운동능력을 향상 시킬 수 있다(Little et al., 2011). 앞서 언급된 연구들에서 동일한 2주간의 훈련임에도 불구하고 겨우 6회의 SIT 훈련으로 운동지속시간을 2배나 증가시킨 점은 엘리트 선수들의 체력훈련에 소비되는 시간을 획기적으로 줄이면서 지구력을 증가시킬 수 있다는 장점을 가질 수 있다.
이와 같이 SIT 훈련 결과 지구력이 향상된 생리학적인 근거로서는 페달링 파워와 유산소성 효소(citrate synthase, malate dehydrogenase)의 활성이 증가되어 운동지속시간이 향상될 수 있지만 최대산소섭취량의 유의한 변화 또한 관찰되지 않은 것을 알 수 있다. 그러므로 유산소성 운동능력의 향상을 위한 대안으로서 고지대트레이닝(high altitude training) 또는 저산소 챔버(simulate hypoxic chamber)를 이용하여 SIT 훈련과 접목한다면 비교적 단기간에 무산소성 페달링 파워 및 유산소성 기능의 향상이라는 두 가지 훈련 효과를 달성할 수 있을 것이라고 가정 할 수 있다. 이 같이 예상되는 효과는 뚜렷한 훈련목표를 가지고 훈련하는 엘리트 선수 특히, 지구력이 요구되는 운동선수에게는 훈련시간을 효율적으로 활용함으로서 목적 달성에 효과적일 수 있을 것이다. 이 중 실험실 조건에서 고지대훈련을 모방할 수 있는 hypoxic chamber을 이용한 처치는 해외 등의 고(산)지대로 이동함으로서 많은 시간과 경비를 낭비하지 않고 급격한 고지로의 이동으로 인한 고산병과 같은 역효과 또한 최소화 할 수 있을 것이다. 또한 해수면에서도 고지대 거주에서 얻을 수 있는 새로운 개념의 고지대 훈련을 실시함으로서 적혈구 증가 등의 산소운반 능력 향상, 근육 및 신경 기능의 향상을 동시에 도모할 수 있는 고강도 훈련을 병행하는 트레이닝 방법을 사용할 수 있다.
초기의 고지트레이닝에 관한 연구들(Dill & Adams, 1971; Faulkner et al., 1968; Levine et al., 1991)을 근거로 전통적인 고지대 훈련에서 벗어나 새로운 개념의 모델에 대한 관심과 연구가 활발히 진행되면서 이를 지원할 수 있는 훈련 장비들이 개발되어 왔다. 그렇지만 이 같은 장비를 활용한 훈련이 적혈구와 최대산소섭취량 증가에 효과가 있다는 연구결과들이(Mattila & Rusko, 1996; Rusko et al., 1999)이 있는 반면, 혈액학적 변인에는 효과가 있으나 산소섭취 능력에는 효과가 없었다는 연구(Piehl-Aulin et al., 1998)와 두 가지 모두에 효과가 나타나지 않았다는 결과(Ashenden et al., 1999b; Dehnert et al., 2002)도 보고되었다. 또한, 과거의 연구들에서 주로 실시되었던 저압·저산소 형태는 평압·저산소에 비해 생리학적 측면에서 부정적인 요소들이 존재한다. 첫째, 호흡 가스의 밀도로 인한 폐포 환기와 확산 능력의 차이(Conkin & Wessel, 2008), 둘째, 폐 혈류량의 차이로 인한 헤모글로빈 불포화 현상이 저압·저산소 환경에서 더 크게 나타난다. 셋째, 이로 인하여 산화스트레스 및 염증 반응의 증가, 두통, 구토 및 어지럼증과 같은 고산병(high altitude illness)등의 부정적 증상들이 나타남에 따라 훈련 부적응을 초래하게 된다. 이와 같은 이유로, 최근에는 고지 또는 저산소 처치 및 훈련 모형이 크게 고지대 거주·고지대 훈련(living high-train high, LHTH)과 고지대 거주·저지대 훈련(living high-train low, LHTL) 형태의 연구 결과들이 다수 보고되고 있다(Brugniaux et al., 2006; Humberstone-Gough et al., 2013; Gore & Hopkins, 2005; Issurin, 2007; Robach et al., 2006). 그렇지만 이와 같은 모형들에서 혈액학적 변인들과 유·무산소성 운동 능력의 향상을 위해서는 저산소 노출만으로는 하루에 8-12시간이 요구되는 것으로 관찰되었으며, Millet et al.(2010)의 보고에서도 최소 3주 이상(<18일) 또는 4주로 제시하고 있는 것과 같이 시즌 중 시합과 훈련을 병행해야 하는 엘리트 선수들에게는 효율적이고 경제적인 방법이 검증되어 적용되어야 한다. 그러므로 새로운 개념의 고지대 훈련 효과에 대한 연구결과들에서 산소분압의 정도, 저산소 환경에 노출된 시간, 기간, 피험자들의 체력수준, 훈련 강도, 그리고 훈련 통제 등의 원인으로 각기 다른 결과들이 제시되고 있어 실증적인 검토가 필요하다.
따라서 본 연구는 유·무산소성 운동능력을 동시에 필요로 하는 엘리트 테니스 선수(Kovacs, 2007)를 대상으로 평압·저산소 환경에서 4주 동안 SIT와 점진적인 저산소 처치가 혈액학적 변인 및 유·무산소성 운동능력에 미치는 영향을 검증하는데 그 목적이 있었다.
연구 방법
연구 대상
본 연구의 대상자는 서울 소재의 K대학교 남자 테니스선수 16명을 선정하였다. 이들은 통제집단(CON)과 실험집단(SITH)으로 각각 무선 배정하여 분리하고 <표 1>, 참여 전에 연구의 목적과 절차에 대한 충분한 설명을 듣고 동의서에 서명한 후 자발적으로 참여하였다.
연구 설계
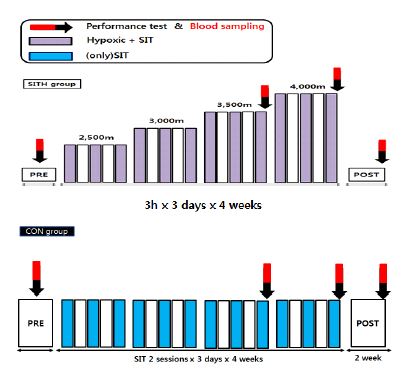
두 집단의 대상자들은 실험과정에서 부여한 처치를 진행하면서 평소의 훈련은 공통적으로 동일한 지도자의 통제 및 관리 하에 실시하였다. 총 6주간의 실험기간 동안 각 집단의 처치는 4주 동안 이루어졌으며, 나머지 2주는 회복기간(POST-2)으로 설정하였다. CON 집단은 실험 기간 동안 해수면 수준에서 SIT만 적용되었으며, SITH 집단(SIT+Hypoxic)은 4주 동안 주당 3일, 하루에 3시간씩 2회의 SIT를 추가적으로 실시한 후 저산소 처치가 이루어졌다. 모든 검사와 측정은 <그림 1>에서 제시한 바와 같이 Pre, 처치가 종료되는 시점인 4주 후, 그리고 종료된 시점에서 2주가 지난 POST-2에서 공통적으로 진행되었다.
처치 방법
2013년 시즌 중 K대학교 테니스 선수를 대상으로 훈련기간 중에 이루어졌다. 본 연구에 참여하는 두 집단의 모든 피험자는 평소 동일한 훈련을 실시하게 되었으며, CON 집단은 일과 시간의 훈련 후 4주 동안 하루에 2회씩, 1주일에 3일 동안 해수면 수준(20.9% O2)에서 SIT를 실시하였다. 또한 SITH 집단은 동일한 실험 기간 동안 하루에 3시간씩 평압·저산소 챔버(normobaric hypoxic chamber, b-cat, SIEMENS, Netherlands)에서 저산소 노출과 함께 CON 집단과 동일한 방법으로 SIT가 추가로 적용되었다.
본 연구에서 이용된 평압·저산소 챔버의 대기압은 해수면 수준(~760mmHg)으로 유지하되 질소(N2)를 함유시켜 산소 농도를 낮추는 방식의 인위적(simulate)인 장비로서 2,500m의 산소농도에서 처치를 시작하여 매주 500m씩 고도를 상승시켜서 산소의 농도를 점진적으로 감소시키는 처치가 이루어졌다. SIT는 챔버에서 4주 동안 1주일에 3일, 하루에 2회씩, 세트 간의 휴식은 4분으로 설정하여(Burgomaster et al., 2005) SITH 집단만 실시하였으며, 실험기간 중 별도의 체력훈련 등은 금지하였다. 4주간의 처치가 끝난 후 2주 동안은 회복기 기간으로 설정하여 실험 기간 동안 적용되었던 처치 없이 동일한 일과 시간의 훈련만 진행하였으며, 사후검사 개념으로 POST-2에서 체력측정과 혈액검사가 이루어졌다.
측정항목 및 방법
본 연구에서는 평압·저산소 환경에서 SIT와 단시간의 저산소 환경 노출이 산소운반 관련 혈액학적 변인과 유·무산소 운동능력 관련 변인 등에 미치는 영향을 검증하기 위하여 다음과 같은 변인들을 측정하였다.
혈액학적 성분을 분석하기 위하여 공복 상태에서 아침 5~6시 사이에 약 7ml의 혈액을 정중전완정맥에서 채취하여 이중 3 ml은 항응고제를 이용하여 전영상태로 보관하여 망상적혈구(reticulocyte; Ret), 적혈구(red blood cell; RBC), 헤모글로빈(hemoglobin; Hb) 농도, 헤마토크리트(hematocrit; Hct), 및 적혈구조혈인자 호르몬(erythropoietin; EPO) 등을 N 의료재단에 분석을 의뢰하였다. 또한 실험 1주 및 2주차가 종료된 시점에서 혈액 채취는 서전 실험 결과, 변화가 없었던 것으로 관찰되어 생략하였다.
유산소 운동능력 관련 변인은 크게 최대운동부하검사에 의한 최대산소섭취량(VO2max), 최대심박수(HRmax), 운동지속시간(Time), 그리고 최대환기량(VEmax) 등이 측정되었다. 운동부하검사를 위해 트레드밀을 약 6%의 경사에 고정하고 최초에는 80m/min의 속도에서 걷기를 시작하여 2분마다 20m/min씩 점증적으로 부하를 증가시키는 KISS protocol(체육과학연구원, 2007)을 사용하였다. 점증 운동부하 중에 자동호흡가스분석장치(Quark b2, Italy)를 이용하여 20초마다 호기가스를 분석하였으며, 심박수 측정기를 이용하여(Polar, Finland) 20초마다 심박수를 측정하였다. 이와 같은 방법에 의하여 all-out 또는 탈진에 의한 종료 시점, 호흡 교환율이 1.1 이상 되는 시점, 운동 강도는 증가하는데 심박수 및 VO2가 증가하지 않는 경우 또는 운동 자각도(RPE, Borg scale)에서 그 수준이 19 이상 관찰 되었을 때를 기준으로 하여 종료 시점을 판단하였다. 최대산소섭취량은 all-out까지의 산소섭취량의 최대치로 결정하였으며, 최대심박수는 운동부하검사 중에 도달된 심박수의 최고치로, 탈진할 때까지 지속한 운동시간을 최대운동지속시간으로 결정하였다. 이외에도 운동부하검사 중에 관찰 할 수 있는 분당호흡수, 1회 호흡량 및 호흡교환율(RER) 등 호흡 순환계 변인들이 측정되었다.
무산소성 운동능력관련 변인은 윈게이트 무산소성 테스트(WAnT)에 의한 방법으로 측정하였다(Inbar et al., 1996). 이 방법은 전기 저항식 사이클 에르고미터(Excalibur, LODE, Netherlands)를 이용하여 선수의 힘과 자전거 페달링 회전율과의 관계에 의해 최대 파워를 측정하기위해 보편적으로 이용되어 지고 있다. 무산소성 운동능력 측정을 위한 부하방법은 150-160 beats/min 정도로 2-4분 정도 준비운동을 실시하고 3-5분 정도 휴식을 취한 후 본 운동을 실시하였다. 이때 PC와 연결된 사이클 에르고미터 상에서 30초 동안 최대운동을 실시토록 하여 총운동량(total work output), 평균파워(mean power), 최고파워(peak power) 및 피로지수(% fatigue index)가 산출되어 데이터로 활용하였다.
자료처리 방법
모든 측정 변인들에 대해서는 SPSS(20.0 Ver.)를 이용하여 평균(M)과 표준편차(SD)를 산출하였다. 혈액학적 변인 및 유·무산소성 운동능력에 대한 상호작용효과 및 주효과 검증을 위해 Two-way repeated measures ANOVA를 사용 하였다. 주효과에 따른 사후검증으로 집단 내 시기 간의 차이는 One-way repeated measures ANOVA, 집단 간의 차이는 Independent t-test를 적용하였다. 모든 유의 수준은 α=.05로 설정하였다.
결 과
혈액학적 변인
혈액학적 변인들에 대하여 반복측정 이원분산분석 분석을 실시하여 집단 간 및 시기 간에 변화를 분석한 결과는 <표 2>와 <그림 2, 3>에서 제시한 바와 같다. 우선, 적혈구(RBC)에서는 유의한 변화가 나타나지 않았지만 SITH 집단은 End test 시점인 4,000m에서 Pre 때 보다 증가한 경향을 보였다. 헤모글로빈(Hb)과 헤마토크릿(Hct)에서는 시기 간의 주효과가 각각 유의하게 나타났다(p<.05, p<.01; vs. Pre). Hb의 주효과에 대한 사후분석 결과 CON 집단은 변화가 없었으며, SITH 집단은 4,000 m에서 Pre와 비교해 유의하게 증가하였으며(p<.05), Hct는 CON 집단에서는 증가한 경향만을 나타낸 반면, SITH 집단은 Pre와 비교해 4,000m에서 유의한 수준으로 증가하였다(p<.01). 또한 Lactate는 시기 간의 주효과가 유의하게 나타남(p<.05)에 따라 SITH 집단은 Pre와 비교해 시기별로 모두 증가한 결과를 보였다. 따라서 산소운반 능력과 관련된 혈액 변인들은 SITH 집단에서 유의하게 증가된 결과 및 경향을 보였다.
유산소성 운동능력 변인
유산소성 운동능력 관련 변인들에 대한 결과는 <표 3>에서 제시한 바와 같다. Treadmill test를 통한 운동지속시간(Time)은 시기 간에 주효과에서 유의하게 나타났으며(p<.05), 이에 따른 사후분석 결과 CON 집단은 Pre와 비교해 유의한 변화가 관찰되지 않았지만 SITH 집단에서는 4,000m에서 유의한 수준으로 증가한 결과를 보였다(p<.05).최대산소섭취량(VO2max)에서는 주효과와 상호작용 효과 모두 유의 수준이 나타나지 않았지만 SITH 집단은 4,000m에서 증가된 경향을 보였다(p=.072). CON 집단은 변화가 나타나지 않은 반면에 SITH 집단은 증가한 경향을 보임에 따라 긍정적인 결과를 나타낸 것으로 사료된다. 또한 VEmax와 HRmax는 모두 유의한 변화는 관찰되지 않았다.
무산소성 운동능력 관련 변인
무산소성 운동능력 관련 변인들에 대한 결과는 <표 4>에서 제시한 바와 같다. 우선, 피크파워의 절대치(PP, W)에서 시기 간의 주효과가 유의하게 나타남(p<.05)에 따라 4,000m에서 두 집단 모두 각각 Pre 때 보다 유의하게 증가하였다(p<.05). 피크파워의 상대치(PP, W/kg)에서도 시기 간의 주효과가 유의하게 나타났으며(p<.05), 사후분석 결과 SITH 집단에서 Pre와 비교해 3,500m와 4,000m에서 각각 유의하게 증가한 결과를 보였다(p<.05). 평균파워의 절대치(MP, W)에서는 유의성이 나타나지 않았지만 두 집단 모두 Pre와 비교해 증가한 경향을 보였으며, 평균파워의 상대치(MP, W/kg)에서도 두 집단 모두 증가한 경향만 나타났다. 또한 피로지수(FI)는 SITH 집단에서 4,000m 때 유의하게 증가한 결과를 보였으며(p<.01), 총 일량(TW)은 두 집단 모두 증가한 경향을 보였다. 전반적으로 SITH 집단은 Pre와 비교해 유의한 수준으로 증가한 결과 또는 경향을 보였으며, CON 집단에서도 PP(W)에서 유의하게 증가한 것을 비롯하여 power output이 증가한 경향이 나타났다.
논 의
Blood parameters
혈액변인들에서 유의하거나 긍정적인 변화들을 나타낸 결과들은 강도 높은 훈련 프로그램과 더불어 점증적인 저산소 처치로 인하여 대사적 스트레스 또한 증가하여 나타난 결과일 것이다. 특정한 훈련 목표에 따라 지구성 훈련을 통한 대사적 스트레스는 탄수화물 고갈 또는 공복 상태에서 훈련 기간과 강도를 증가시킴으로서 더욱 높일 수 있다(Van Proeyen et al., 2011 2011). 또 다른 방법으로는 hypobaric(i.e., altitude) 또는 normobaric hypoxia(i.e., simulated altitude)에서 산소 농도를 낮춘 상태에서 훈련하는 것이다(Schmutz, et al., 2010). 따라서 본 연구에서는 SIT를 normoxia와 hypoxia에서 동일하게 실시하고 hypoxia에서는 SIT가 종료된 후 추가적으로 3 시간 동안 노출시켰다. 그 결과 Hb와 Hct에서 시기 간에 주효과가 나타났으며(p<.05), 이에 따른 사후분석에서 SITH 집단이 4,000 m(12.6% O2)에서 Pre 보다 각각 유의하게 증가하였다(p<.05, p<.01). 현재까지 보고된 저산소 관련 문헌들에서도 유산소성 운동 능력에 직접적으로 영향을 미칠 수 있는 혈액 변인들이 유의한 수준으로 증가 되었다는 결과가 다수이다. 그 중 Basset et al.(2006)은 평압·저산소 환경에서 3주 동안 하루에 8시간씩 주 2회 노출(수면)과 함께 해수면에서 3일 훈련(런닝, 사이클 및 웨이트 트레이닝)을 실시했음에도 불구하고 RBC, Hct 및 EPO가 증가하였다. 또한 Richalet & Gore 등(2008)에서도 수영선수들을 대상으로 13일 동안 하루에 16시간씩 2,500m-3,000m에서 노출시키고 1,200m에서 훈련을 시킨 결과 RCV(red cell volume)와 Hb가 유의하게 증가하였다. 반면, Morton & Cable(2005)이 보고한 문헌에 따르면 2,750m의 평압·저산소 환경에서 사이클 훈련을 하루에 30분/주 3회/4주 동안 실시한 실험집단과 해수면에서 동일한 프로토콜로 훈련만 실시한 통제집단 모두 Hb와 Hct의 유의한 변화가 나타나지 않았다. 이와 같은 결과는 엘리트 선수들을 대상으로 LHTL 모형에서 2주 동안 진행된 실험 결과 Hb와 EPO의 유의한 변화가 관찰되지 않은 Dehnert et al.(2002)의 결과와 유사하다. 본 연구에서도 SITH 집단에서 3,500m과 4,000m 고도에서 Hb와 Hct 즉, red cell volume이 유의한 수준으로 증가하였지만 EPO, reticulocyte, 그리고 ferritin은 유의한 변화가 나타나지 않았다.
또 다른 Chapman et al.(1998)의 보고에서는 2,500 m 고도에서 27일 동안 노출과 함께 1,250 m에서 훈련을 시켜 노출 시킨 첫 20시간 내에 EPO가 92% 증가하였다고 보고했으며, Mounier et al.(2009b)의 연구에서도 3,000 m에서 3시간 노출과 함께 1,200 m에서 훈련(acute)을 통하여 EPO가 매우 유의한 수준으로 증가하였다고 보고하였다. 해수면에서의 유산소성 운동능력에 중요한 생리학적 적응인 흡입기산소분압(PIO2)의 감소는 일시적으로 적혈구의 수가 증가됨에 따라 신장에서 분비되는 EPO 또한 증가되기 때문이라는 주장(Bailey & Davies, 1997)이 이들의 연구결과를 지지하는 것으로 보인다. 그렇지만 본 연구에서는 적혈구 세포가 증가됨에도 불구하고 EPO의 유의한 변화는 관찰되지 않았다. EPO 생성에 있어서 우선시되는 기전으로는 저산소 유도인자인 HIF(hypoxia-inducible factor)의 활성화에 의해 영향을 받는 것으로 보인다. 낮은 산소분압(PO2)은 세포가 적응할 수 있는 최적의 환경으로서 EPO, angiogenesis(i.e. VEGF), 그리고 당대사에 관여하는 효소들과 같은 단백질 등은 전사 인자(transcription factors)로 불리는 HIF이 중재한다(Mounier, 2009a). 이는 세포 수준에서의 저산소 적응이라 할 수 있으며(Morton & Cable, 2005), 그 중 HIF-1a가 생리학적 적응 과정에 가장 활발하게 작용을 하는 것으로 보인다. 또한 일반적으로 EPO는 저압·저산소(hypobaric hypoxia)의 자극에 따라 즉, 새로운 강한 자극이 부여됨으로서 급격한 반응을 보이다가 어느 수준에서 적응이 된 후 에는 원래의 분비 패턴을 보이는 것으로 보고(Berglund et al., 2002)됨에 따라 본 연구에서도 SITH 집단에서 3,500 m에서 증가하여 그 이 후에는 Pre 수준으로 감소하는 경향을 보였다. 이는 점증적인 저압·저산소 자극이 주어진 후의 시간경과에 따른 채혈 시기 또한 측정값에 영향을 미칠 수 있었을 것으로도 판단되며, 본 연구의 평압·저산소 환경이 세포 수준에서의 EPO의 자극을 미치기에는 부족했던 것으로 생각된다. 동시에 대상자들의 불가피한 연중행사 및 시합 참가에 따른 일시적인 고강도 훈련에 의한 부정적 요인 즉, 최고치의 신체작업 및 운동은 대사적 산증(acidosis)을 야기 시킴으로서 EPO의 분비를 억제한다는 Schmidt et al.(1991)의 주장이 본 연구의 가설과 다른 결과를 나타낸 요인으로 판단된다.
본 연구에서 일시적인 고강도 훈련은 제한점으로 여겨지지만 이는 CON 집단 또한 동일한 조건 하에서 진행되었다. 그렇지만, EPO 등에서 유의한 변화가 관찰되지 않았음에도 저산소 노출과 SIT가 부족했던 산소분압 환경을 대처할 수 있는 방법으로 기여함으로서 노출 시간과 고도의 동반 상승이 유의하게 증가된 혈액변인에 최대한 영향을 미친 것으로 판단되며, 특히, SITH 집단은 산소운반과 관련된 혈액변인들이 Pre와 비교해서 실험 종료 후 2주(Rec. 2)까지 유지 및 증가된 경향을 보였다. 이 같은 적응은 모세혈관의 산소 분압을 증가시켜 산소해리곡선의 우측 이동 즉, Bohr effect에 의한 결과라고 할 수 있으며, 선수들을 위한 효율적인 훈련방법의 일환으로서 현장적용에도 기대를 할 수 있을 것으로 생각된다.
Aerobic capacity
1980년 중·후부터 저압·저산소 환경에서의 노출 및 훈련으로 인한 호흡 순환계에 대한 연구들은 지속적으로 보고되고 있으며, 동시에 지구성 운동 종목의 선수들에게 집중적으로 적용되어져 왔다. 그 중 대표적인 Levin et al.(1991)의 연구에서는 27일 동안 2,500-3,000m 고도에서 생활하고 1,250m에서 훈련하는 LHTL(live high-train low) 모형을 일찍이 실행하여 유산소성 운동 능력이 향상되었다고 보고하였다. 본 연구에서도 이와 유사한 모형이긴 하지만 매주 마다 고도를 500m씩 점진적으로 상승시킨 형태로서 평압·저산소 챔버에서 SIT 훈련과 3시간의 저산소 노출을 병행하여 실시한 SITH 집단에서 운동지속시간(time to exhaustion) 만이 Pre와 비교해 4,000m 때에 유의하게 증가하였으며(p<.05), VO2max(ml/kg/min) 또한 4,000 m 때인 4주차에 증가한 경향을 보였다. 그렇지만 정동식 등(2004)등의 문헌에서는 4주 동안 3,000m의 고도(normobaric)에서 하루에 8시간씩 노출 시키고 해수면 수준에서 지구성 훈련을 실시한 결과 VO2max는 증가된 경향만 보였으며, Dehnert et al.(2002)의 연구에서도 저산소 노출 후 VO2max의 유의한 변화는 관찰되지 않았다고 보고하였다.
한편, Rusko et al.(1999)은 2,500m 고도의 평압·저산소 환경에서 25일간 하루에 12-16시간 노출시킨 결과 VO2max가 7일부터 3% 증가하기 시작하여 실험 종료 시점에서는 유의하게 증가되었다고 보고하였다. 또한 Katayama et al.(2004)은 12%의 산소농도(약 4,000-4,200m)의 고도에서 14일간 하루에 3시간씩 매일 노출시키고 훈련은 해수면 수준의 트랙에서 실시한 결과 최대운동 테스트에서는 VO2max를 비롯한 유산소성 변인들의 변화가 없었지만 최대하(submaximal)에서는 VO2와 HR이 유의하게 감소하여 운동 효율성(running economy)이 향상되었다고 보고하였다. 그리고 Richalet & Gore(2008)의 연구에서는 수영과 스키 선수들을 대상으로 각각 13일과 18일 동안 2,500-3,000m 고도(normobaric)에서 노출시키고 1,200m 고도에서 훈련을 실시한 후 VO2max가 실험 종료 후 3일(Rec.1)과 12일(Rec.2) 동안 Pre와 비교하여 유의하게 증가되었으며, Morton & Cable(2005) 또한 평압·저산소의 2,750 m 고도에서 4주 동안 주당 3일씩 하루에 30분 동안의 비교적 짧은 시간 노출을 시키고 훈련은 해수면 수준에서 하루에 30분씩 사이클 훈련을 실시한 결과 VO2max가 통제 집단과 비교하여 유의하게 증가하였다. 본 연구에서도 4,000 m에서 매우 유의한 수준(p<.01)으로 증가하여 Rec.1에서는 소폭 감소한 경향을 보였지만 Pre와 비교하여 8.7% 증가된 수준을 보였다. 따라서 다수의 문헌들에서 보고된 바와 같이 저산소에서의 훈련뿐만 아니라 저산소 노출 또한 VO2max의 증가에 유효한 방법으로 적용될 수 있는 측면이 더욱 설득력이 있다고 생각되며, 저산소노출에 의한 VO2max의 증가는 Hb의 증가, 근세포의 미토콘드리아와 마이오글로빈의 증가(Hahn & Gore, 2001), 모세혈관 밀도의 증가로 인한 근세포 내로 산소운반 능력 확산(Mazzeo, 2008), 그리고 유산소성 대사 효소의 활성(Terrados et al., 1990) 등의 적응이 긍정적으로 영향을 미치는 요인이라 할 수 있다. 특히 저산소 노출로 인한 Hb의 추가적인 합성으로 인하여 VO2max가 향상되는 효과를 관찰할 수 있는데, 이것은 혈액 공급능력인 심박출량의 변화 없이 Hb 추가적 합성을 통한 동맥 내 산소분압의 증가를 통하여 동정맥 산소차이를 증가시켜서 산소이용능력의 증가에 기인한 것으로 생각된다.
현재까지 운동을 통한 환기(ventilatory) 조절 반응 및 적응에 대한 논의는 지속적으로 이어지고 있는 가운데 본 연구에서의 분당환기량은(VE, l/min) 3,000-4,000m에서 유의하게 증가하였다. 저산소 환경을 통한 환기 적응(ventilatory acclimatization to hypoxia, VAH)은 노출 시간과 관련이 있으며, 산소 운반 능력을 증가 시킨다(Sheel & MacNutt, 2008). 예를 들어, 4,000m 고도에서 저산소 환경에 적응된 건강한 사람이 적당한 고강도 운동을 실시할 때 동맥혈산소분압(PaO2)은 약 ~40mmHg 정도(Dempsey et al., 1977)이지만 과호흡 또는 과환기(hyperventilation) 상태가 아닐 때에는 약 25-30mmHg 수준에 이른다. 이는 "고지 절약 효과" (altitude sparing effect)로서 VAH이라 할 수 있으며, 특히 운동 중에 두드러지게 나타난다(Sheel & MacNutt, 2008). 이와 같은 결과는 저산소 환기 반응(hypoxic ventilatory response, HVR)과 경동맥 소체(carotid body)의 산소 감수성(O2 sensitivity)이 증가된 이유로 받아 들여 지고 있으며(Busch et al., 1985), 이 같은 생리학적 기전으로는 화학수용기(chemoreceptor)가 동맥혈의 O2, CO2, 및 pH의 정보를 구심성 경로를 통하여 받게 되는데, 이는 뇌하수체의 배내측(dorsomedial) 설인신경(glosspharyngeal nerve)을 통하여 경동맥 소체에서 이를 감지함으로서 뇌에 전달하게 된다. 한편, Foster et al.(2006)과 Katayama et al.(2002)은 간헐적인 저산소 노출 후 평압 환경에서 항정상태 또는 점증적 운동 중 유효한 환기 반응을 관찰하지 못하여 간헐적인 저산소 노출을 통한 HVR이 증가되지 않는 것으로 보고하였다. 이에 반해 Gore et al.(2001)과 Townsend et al.(2005)은 LHTL 모형을 통하여 최대 운동 중 환기량이 증가되었으며, Rodriguez et al.(1999)은 4,000-5,500 m의 고도에서 하루에 3-5시간씩 9일 동안 노출 시킨 결과 해수면 수준에서 최대 운동 중 환기량이 5.5% 증가되어 본 연구와 유사한 결과를 보였다. 따라서 지속적인 저산소 환경 노출은 화학수용기의 감수성 증가 즉, 경동맥 소체의 활성화로 인하여 환기 반응을 증가 시킬 수 있으며(Duffin & Mahamed, 2003; Powell, 2007; Robbins, 2007; Wilson et al., 2005), Sheel & MacNutt(2008)또한 LHTL 모형에서도 환기량이 증가 하는 것으로 보고함에 따라 환기량의 반응에 대한 논쟁 속에서 그 설득력이 있다고 하겠다.
Anaerobic capacity
현재까지 저산소 환경에서 훈련 및 처치를 통한 유산소성 운동 능력은 비중 있게 보고되어 왔던 것에 비해 무산소성 운동 능력에 관한 연구는 아직 미비한 것으로 관찰된다. 본 연구에서는 저산소 처치 외에 두 집단 모두 4주 동안 주당 3회, 하루에 2번씩 사이클 에르고미터를 이용한 스프린트 인터벌 훈련(SIT)을 동일하게 실행하였다. SIT는 Burgomaster et al.(2005)에서 사용되었던 방법을 변형하여 적용하였으며, 훈련방법은 30초 동안 최대 운동강도로 페달링을 실시한 후 약 4분간의 휴식을 가지고 동일한 방법으로 1회를 추가적으로 실시하였다. Burgomaster et al.(2005)과 윤재량 등(2010)의 연구에서는 SIT를 격일로 실시하되 하루에 시행되는 횟수는 4-7회까지 실시하였지만 본 연구에서는 대상자들의 주 종목인 테니스 훈련을 비교적 강도 높게 실행되었던 점을 감안하여 선행 연구들보다 SIT 시행 횟수를 소폭 감소하여 적용하였다. 그 결과 30초 무산소성 사이클 측정을 통한 피크파워(PP)의 절대값(W)은 두 집단 모두 4,000 m인 4주차에 Pre와 비교해 각각 유의한 수준(p<.05)으로 증가하였지만 집단 간의 차이는 나타나지 않았다. 피크파워의 상대값(W/kg)에서는 SITH 집단에서만 3주(3,500 m)와 4주(4,000m) 때에 Pre 보다 각각 유의하게 증가(p<.05)하였지만 역시 집단 간의 차이는 보이지 않았다.
본 연구와 유사한 실험설계로 보고된 Morton & Cable(2005)는 2,750 m의 평압·저산소 환경에서 실험집단은 4주 동안 주당 3일, 하루에 3시간씩 저산소 노출과 함께 30분 동안 사이클 훈련을 실시하였으며, 통제 집단은 해수면 수준에서 사이클 훈련만 실시한 결과 두 집단 모두 피크파워와 평균파워의 절대값 및 상대값이 사후에 각각 유의한 수준으로 증가하였지만 집단 간의 유의한 차이는 나타나지 않음으로서 본 연구와 유사한 결과를 보였다. 한편, Puype et al.(2013)은 해수면과 저산소(약 3,000m) 환경에서 6주 동안 SIT(30초 스프린트, 세트 간 4.5분 휴식) 프로그램을 각각 동일하게 실시한 결과 사이클링 스프린트 능력은 두 집단 모두 사후에 각각 유의하게 증가하였으며, 집단 간의 차이는 나타나지 않았다. 그렇지만 저산소 환경에서 SIT를 실시한 집단에서는 율속효소(PFK)가 사후에 매우 유의한 수준으로 증가하였다. 이와 같이 짧은 고강도 무산소성 운동은 저산소 노출에 영향을 받지 않으며(Weyand et al., 1999), 이는 선수들이 고지노출에 의해 정상적인 운동 강도를 유지할 수 있다는 것을 시사한다. 따라서 저산소 환경으로 인한 감소된 산화 에너지 회전율을 회복하기 위해 충분한 해당과정을 통한 ATP 생성 비율이 증가되는 것으로 설명되며(Puype et al., 2013), 해수면 수준과 비교하여 해당과정을 위한 스트레스가 증가하게 되고 이는 아마도 해당과정 에너지 경로를 up-regulation하는 것으로 생각된다. 사실, 지속적인 고강도 훈련은 PFK가 활성화 되어 해당과정을 자극함으로서 무산소성 ATP 생산율을 높이며(MacDougall et al., 1998), 이 같은 훈련을 저산소 환경에서 실시했을 때 해수면 수준에서 보다 PFK의 mRNA 발현율이 더욱 증가하게 된다(Zoll et al, 2006). 이 같은 결과는 아마도 저산소에서 훈련이 HIF-1⍺가 활성화되어 PFK 전사를 자극하는 것으로 보인다.
본 연구 또한 짧은 고강도 무산소성 훈련은 저산소 노출에 영향을 받지 않는다는 이론적 배경에 의해 실험 설계가 이루어졌으며, 저산소 환경에서 적은 양의 SIT가 해수면 수준에서 동일한 훈련 보다 골격근 내 유·무산소성 에너지 turnover을 촉진하는 생리학적 이점이 많기 때문에 더 강한 훈련 방법이라 생각되었다. 그럼에도 불구하고 생화학적 및 분자 수준에서의 변인들을 관찰하지 못한 점에 대해서는 제한점이 존재하는 것으로 생각되며, 한편으로, 운동량과 저산소 환경에 노출된 시간 또한 CON 집단과의 유의한 차이를 나타내기에는 즉, 분자적인 측면을 자극하기에 다소 부족한 점이 있었던 것으로 판단된다.
결 론
이상의 결과들을 종합해 보면, 최근까지 저산소 훈련에 관한 연구들에서는 전통적으로 고정적인 부하로 유산소성 형태의 운동을 실시해 왔다. 그렇지만 적당 고도의 저산소 환경에서 SIT는 해수면과 고지에서 선수들의 지구성 운동 능력을 향상 시킬 수 있는 또 다른 대안이 될 수 있다. 이 같은 관점에서 본 연구의 결과들은 산소운반 능력과 관련된 혈액변인들과 유산소성 운동 능력은 저산소 환경에서 고강도 훈련을 통하여 유의하게 증가한 결과들을 보였지만 무산소성 운동능력의 경우 해수면 수준에서 동일한 훈련을 실시했을 때와 비교하여 유의한 차이는 나타나지 않았다. 또한 저산소 노출만 실시하는 집단이 추가적으로 설정되었더라면 더욱 객관적인 연구가 될 수 있었던 제한점은 본 저자들 및 기존의 선행연구들의 결과들을 토대로 판단하여 배제하였다. 따라서 후속연구에서는 저산소 환경에서 고강도 훈련을 통한 세포 및 분자 수준을 자극할 수 있는 저산소 노출 시간 및 운동량에 대한 추가적인 검증이 필요하다.
Acknowledgements
본 논문은 2012년 정부(교육과학기술부)의 재원으로 한국연구재단의 지원을 받아 수행된 연구임(NRF-2012S1A5A2A01020882).
References
체육과학연구원(2007). 체육과학연구원 체력 측정 및 평가 매뉴얼. 서울: 국민체육진흥공단 체육과학연구원.
체육과학연구원. 2007. 체육과학연구원 체력 측정 및 평가 매뉴얼 서울: 국민체육진흥공단 체육과학연구원.윤재량, 오재근, 전해섭. (2010). 스프린트인터벌 트레이닝 및 트레이닝 중지가 지구력 및 대사변인에 미치는 영향. 한국체육학회지, 49(1), 413-426.
윤 재량, 오 재근, 전 해섭. 2010;스프린트인터벌 트레이닝 및 트레이닝 중지가 지구력 및 대사변인에 미치는 영향. 한국체육학회지 49(1):413–426.Ashenden, M. J., Gore, D. T., Martin, G. P., Dobson, G. P., & Hahn, A. G. (1999b). Effects of a 12-day ʻʻlive high, train lowʼʼ camp on reticulocyte production and haemoglobin mass in elite female road cyclists. European Journal of Applied Physiology, 80(5), 472-478.
Ashenden M. J., Gore D. T., Martin G. P., Dobson G. P., et al, Hahn A. G.. 1999b;Effects of a 12-day ʻʻlive high, train lowʼʼ camp on reticulocyte production and haemoglobin mass in elite female road cyclists. European Journal of Applied Physiology 80(5):472–478. 10.1007/s004210050620.Bailey, D. M., & Davies, B. (1997). Physiological implications of altitude training for endurance performance at sea level: a review. British Journal of Sports Medicine, 31(3), 183-190.
Bailey D. M., et al, Davies B.. 1997;Physiological implications of altitude training for endurance performance at sea level: a review. British Journal of Sports Medicine 31(3):183–190. 10.1136/bjsm.31.3.183.Basset, F. A., Joanisse, D. R., Boivin, F., St-Onge, J., Billaut, F., Dore, J., Chouinard, R., Falgairette, G., Richard, D., & Boulay, M. R. (2006). Effects of short-term normobaric hypoxia on haematology, muscle phenotypes and physical performance in highly trained athletes. Experimental Physiology, 91(2), 391-402.
Basset F. A., Joanisse D. R., Boivin F., St-Onge J., Billaut F., Dore J., Chouinard R., Falgairette G., Richard D., et al, Boulay M. R.. 2006;Effects of short-term normobaric hypoxia on haematology, muscle phenotypes and physical performance in highly trained athletes. Experimental Physiology 91(2):391–402. 10.1113/expphysiol.2005.031682.Berglund, B., Gennser, M., Ornhagen, H., Ostberg, C., & Wide, L. (2002). Erythropoietin concentrations during 10 days of normobaric hypoxia under controlled environmental circumstances. Acta Physiologica Scandinavica, 174(3), 225-229.
Berglund B., Gennser M., Ornhagen H., Ostberg C., et al, Wide L.. 2002;Erythropoietin concentrations during 10 days of normobaric hypoxia under controlled environmental circumstances. Acta Physiologica Scandinavica 174(3):225–229. 10.1046/j.1365-201x.2002.00940.x.Burgomaster, K. A., Geroge, J. F., Heigenhauser, & Gibala, M. J. (2006). Effect of short-term sprint interval training on human skeletal muscle carbohydrate metabolism during exercise and time-trial performance. Journal of Applied Physiology, 100, 2041-2047.
Burgomaster K. A., Geroge J. F., Heigenhauser , et al, Gibala M. J.. 2006;Effect of short-term sprint interval training on human skeletal muscle carbohydrate metabolism during exercise and time-trial performance. Journal of Applied Physiology 100:2041–2047. 10.1152/japplphysiol.01220.2005.Burgomaster, K. A., Hughes, S. C., Heigenhauser, G. J. F., Bradwell, S. N., & Gibala M. J. (2005). Six sessions of sprint interval training increases muscle oxidative potential and cycle endurance capacity in humans. Journal of Applied Physiology, 98(6), 1985-2005.
Burgomaster K. A., Hughes S. C., Heigenhauser G. J. F., Bradwell S. N., et al, M. J. Gibala. 2005;Six sessions of sprint interval training increases muscle oxidative potential and cycle endurance capacity in humans. Journal of Applied Physiology 98(6):1985–2005. 10.1152/japplphysiol.01095.2004.Busch, M. A., Bisgard, G. E., & Forster, H. V. (1985). Ventilatory acclimatization to hypoxia is not dependent on arterial hypoxemia. Journal of Applied Physiology, 58, 1874-1880.
Busch M. A., Bisgard G. E., et al, Forster H. V.. 1985;Ventilatory acclimatization to hypoxia is not dependent on arterial hypoxemia. Journal of Applied Physiology 58:1874–1880. 10.1152/jappl.1985.58.6.1874.Brugniaux, J. V., Schmitt, L., Robach, P., Jeanvoine, H., Zimmermann, H., Nicolet, G., Duvallet, A., Fouillot, J. P., & Richalet, J. P. (2006). Living high-training low: tolerance and acclimatization in elite endurance athletes. European Journal of Applied Physiology, 96(1), 66-77.
Brugniaux J. V., Schmitt L., Robach P., Jeanvoine H., Zimmermann H., Nicolet G., Duvallet A., Fouillot J. P., et al, Richalet J. P.. 2006;Living high-training low: tolerance and acclimatization in elite endurance athletes. European Journal of Applied Physiology 96(1):66–77. 10.1007/s00421-005-0065-9.chapman, R. F., Stray-Gunderson, J., & Levine, B. D. (1998). Individual variation in response to altitude training. Journal of Applied Physiology, 85(4), 1448-1456.
chapman R. F., Stray-Gunderson J., et al, Levine B. D.. 1998;Individual variation in response to altitude training. Journal of Applied Physiology 85(4):1448–1456. 10.1152/jappl.1998.85.4.1448.Catillo-Quan, J. I. (2012). From white to brown fat through the PGC-1a dependent myokine irisin: implications for diabetes and obesity. Disease Models & Mechanism, 5, 293-295.
Catillo-Quan J. I.. 2012;From white to brown fat through the PGC-1a dependent myokine irisin: implications for diabetes and obesity. Disease Models & Mechanism 5:293–295.Conkin, J., & Wessel, J. (2008). Critique of the Equivalent Air Altitude Model. Aviation, Space, and Environmental Medicine, 79(10), 975-982.
Conkin J., et al, Wessel J.. 2008;Critique of the Equivalent Air Altitude Model. Aviation, Space, and. Environmental Medicine 79(10):975–982.Dehnert, C., Weymann, J., Montgomery, H., Woods, D., Maggiorini, M., Scherre, U., Gibb, J., & Bartsch, P. (2002). No association between high-altitude tolerance and the ACE I/D gene polymorphism. Medicine and Science in Sports and Exercise, 234(12), 1928-1933.
Dehnert C., Weymann J., Montgomery H., Woods D., Maggiorini M., Scherre U., Gibb J., et al, Bartsch P.. 2002;No association between high-altitude tolerance and the ACE I/D gene polymorphism. Medicine and Science in Sports and Exercise 234(12):1928–1933. 10.1097/00005768-200212000-00011.Dempsey, J. A., Giedhill, N., Reddan, W. G., Forster, H. V., Hanson, P. G., & Claremont, A. D. (1977). Pulmonary adaptation to exercise: Effects of exercise type and duration, chronic hypoxia and hypoxia and physical training. Annals of the New York Academy of Sciences, 301, 243-261.
Dempsey J. A., Giedhill N., Reddan W. G., Forster H. V., Hanson P. G., et al, Claremont A. D.. 1977;Pulmonary adaptation to exercise: Effects of exercise type and duration, chronic hypoxia and hypoxia and physical training. Annals of the New York Academy of Sciences 301:243–261.Dill, D. B., & Adams, W. C. (1971). Maximal oxygen uptake at sea level and at 3,090-m altitude in high school champion runners. Journal of Applied Physiology, 30(6), 854-859.
Dill D. B., et al, Adams W. C.. 1971;Maximal oxygen uptake at sea level and at 3,090-m altitude in high school champion runners. Journal of Applied Physiology 30(6):854–859. 10.1152/jappl.1971.30.6.854.Faulkner, J. A., Kollias, J., Favour, C. B., Buskirk, E. R., & Balke, E. (1968). Maximum aerobic capacity and running performance at altitude. Journal of Applied Physiology, 24(5), 685-691.
Faulkner J. A., Kollias J., Favour C. B., Buskirk E. R., et al, Balke E.. 1968;Maximum aerobic capacity and running performance at altitude. Journal of Applied Physiology 24(5):685–691. 10.1152/jappl.1968.24.5.685.Foster, G. E., McKenzie, D. C., & Sheel, A. W. (2006). Effects of enhanced human chemosensitivity on ventilatory responses to exercise. Experimental Physiology, 91, 221-228.
Foster G. E., McKenzie D. C., et al, Sheel A. W.. 2006;Effects of enhanced human chemosensitivity on ventilatory responses to exercise. Experimental Physiology 91:221–228. 10.1113/expphysiol.2005.032276.Gore, C. J., Hahn, A. G., Aughey, R. J., Martin, D. T., Ashenden, M. J., Clark, S. A., Garnham, A. P., Roberts, A. D., Slater, G. J., & McKenna, M. J. (2001). Live high:train low increases muscle buffer capacity and submaximal cycling efficiency. Acta Physiologica Scandinavica, 173(3), 275-286.
Gore C. J., Hahn A. G., Aughey R. J., Martin D. T., Ashenden M. J., Clark S. A., Garnham A. P., Roberts A. D., Slater G. J., et al, McKenna M. J.. 2001;Live high:train low increases muscle buffer capacity and submaximal cycling efficiency. Acta Physiologica Scandinavica 173(3):275–286. 10.1046/j.1365-201x.2001.00906.x.Gore, C. J., & Hopkins, W. G. (2005). Counterpoint: Positive effects of intermittent hypoxia (live high:train low) on exercise performance are not mediated primarily by augmented red cell volume. Journal of Applied Physiology, 99(5), 2055-2057.
Gore C. J., et al, Hopkins W. G.. 2005;Counterpoint: Positive effects of intermittent hypoxia (live high:train low) on exercise performance are not mediated primarily by augmented red cell volume. Journal of Applied Physiology 99(5):2055–2057. 10.1152/japplphysiol.00820.2005.Hahn, A. G., & Gore, C. J. (2001). The Effect of Altitude on Cycling Performance. Sports Medicine, 31(7), 533-557.
Hahn A. G., et al, Gore C. J.. 2001;The Effect of Altitude on Cycling Performance. Sports Medicine 31(7):533–557. 10.2165/00007256-200131070-00008.Humberstone-Gough. C. E., Saunders, P. U., Bonetti, D. L., Stephens, S., Bullock, N., Anson, J. M., & Gore, C. J. (2013). Comparison of live high: train low altitude and intermittent hypoxic exposure. Journal of Sports Science and Metabolism, 12(3), 394-401.
C. E. Humberstone-Gough., Saunders P. U., Bonetti D. L., Stephens S., Bullock N., Anson J. M., et al, Gore C. J.. 2013;Comparison of live high: train low altitude and intermittent hypoxic exposure. Journal of Sports Science and Metabolism 12(3):394–401.Inbar, O., Bar-Or, O., & Skinner, J. S. (1996). The wingate tests. Champaign, IL: Human Kinetics.
Inbar O., Bar-Or O., et al, Skinner J. S.. 1996. The wingate tests Champaign, IL: Human Kinetics.Issurin, V.(2007). Altitude training: an up-to-date approach and implementation in practice. Sporto Mokslas, 1(47), 12-19.
Issurin V.. 2007;Altitude training: an up-to-date approach and implementation in practice. Sporto Mokslas 1(47):12–19.Katayama, K., Sato, Y., Shima, N., Qiu, J., Ishida, K., Mori, S., & Miyamura, M. (2002). Enhanced chemosensitivity after intermittent hypoxic exposure does not affect exercise ventilation at sea level. European Journal of Applied Physiology, 87(2), 187-191.
Katayama K., Sato Y., Shima N., Qiu J., Ishida K., Mori S., et al, Miyamura M.. 2002;Enhanced chemosensitivity after intermittent hypoxic exposure does not affect exercise ventilation at sea level. European Journal of Applied Physiology 87(2):187–191. 10.1007/s00421-002-0594-4.Katayama, K., Sato, K., Matsuo, H., Ishida, K., Iwasaki, Ki. I., & Miyamura, M. (2004). Effect of intermittent hypoxia on oxygen uptake during submaximal exercise in endurance athletes. European Journal of Applied Physiology, 92(1-2), 75-83.
Katayama K., Sato K., Matsuo H., Ishida K., Iwasaki Ki. I., et al, Miyamura M.. 2004;Effect of intermittent hypoxia on oxygen uptake during submaximal exercise in endurance athletes. European Journal of Applied Physiology 92(1-2):75–83. 10.1007/s00421-004-1054-0.Kovacs, M. S. (2007). Tennis Physiology. Sports Medicine, 37(3), 189-198.
Kovacs M. S.. 2007;Tennis Physiology. Sports Medicine 37(3):189–198. 10.2165/00007256-200737030-00001.Levine, B. D., Stray-Gunderson, J., Duhaime, G., Snell, P. G., & Friedman, D. B. (1991). Living high-training low: The effect of altitude acclimatization/normoxic training in trained runners. Medicine and Science in sports and exercise, 23(suppl.), S25.
Levine B. D., Stray-Gunderson J., Duhaime G., Snell P. G., et al, Friedman D. B.. 1991;Living high-training low: The effect of altitude acclimatization/normoxic training in trained runners. Medicine and Science in sports and exercise 23(suppl.). :S25.Little, J. P., Safdar, A., Bishop, D., Tarnopolsky, M. A., & Gibala, M. J. (2011). An acute bout of high-intensity interval training increases the nuclear abundance of PGC-1α and activates mitochondrial biogenesis in human skeletal muscle. American Journal of Physiology Regulatory, Integrative & Comparative Physiology, 300(6), R1303-1310.
Little J. P., Safdar A., Bishop D., Tarnopolsky M. A., et al, Gibala M. J.. 2011;An acute bout of high-intensity interval training increases the nuclear abundance of PGC-1α and activates mitochondrial biogenesis in human skeletal muscle. American Journal of Physiology Regulatory, Integrative & Comparative Physiology 300(6):R1303–1310. 10.1152/ajpregu.00538.2010.MacDougall, J. D., Hicks, A. L., MacDonald, J. R., McKelvie, R. S., Green, H. J., & Smith, K. M. (1998). Muscle performance and enzymatic adaptations to sprint interval training. Journal of Applied Physiology, 84, 2138-2142.
MacDougall J. D., Hicks A. L., MacDonald J. R., McKelvie R. S., Green H. J., et al, Smith K. M.. 1998;Muscle performance and enzymatic adaptations to sprint interval training. Journal of Applied Physiology 84:2138–2142. 10.1152/jappl.1998.84.6.2138.Mattila, V., & Rusko, H. (1996). Effect of living high and training low on sea level performance in cyclists. Medicine and Science in Sports and Exercise, 28(suppl. 5), S157.
Mattila V., et al, Rusko H.. 1996;Effect of living high and training low on sea level performance in cyclists. Medicine and Science in Sports and Exercise 28(suppl. 5). :S157.Mazzeo, R. S. (2008). Physiological Responses to Exercise at Altitude. Sports Medicine, 38(1), 1-8.
Mazzeo R. S.. 2008;Physiological Responses to Exercise at Altitude. Sports Medicine 38(1):1–8. 10.2165/00007256-200838010-00001.Millet, G. P., Roels, B., Schmitt, L., Woorons, X., & Richalet, J. P. (2010). Combining hypoxic methods for peak performance. Sports Medicine, 40(1), 1-25.
Millet G. P., Roels B., Schmitt L., Woorons X., et al, Richalet J. P.. 2010;Combining hypoxic methods for peak performance. Sports Medicine 40(1):1–25. 10.2165/11317920-000000000-00000.Morton, J. P., & Cable, N. T. (2005). The effects of intermittent hypoxic training on aerobic and anaerobic performance. Ergonomics, 48(11-14), 1535-1546.
Morton J. P., et al, Cable N. T.. 2005;The effects of intermittent hypoxic training on aerobic and anaerobic performance. Ergonomics 48(11-14):1535–1546. 10.1080/00140130500100959.Mounier, R., Pialoux, V., Roels, B., Thomas, C., Millet, G. P., Mercier, J., Coudert, J., Fellmann, N., & Clottes, E. (2009a). Effect of inttermittent hypoxic training on HIF gene expression in human skeletal muscle leukocytes. European Journal of Applied Physiology, 105(4), 515-524.
Mounier R., Pialoux V., Roels B., Thomas C., Millet G. P., Mercier J., Coudert J., Fellmann N., et al, Clottes E.. 2009a;Effect of inttermittent hypoxic training on HIF gene expression in human skeletal muscle leukocytes. European Journal of Applied Physiology 105(4):515–524.Mounier, R., Pialoux, V., Schmitt, L., Richalet, J. P., Robach, P., Coudert, J., Clottes, E., & Fellmann, N. (2009b). Effects of acute hypoxia tests on blood markers in high-level endurance athletes. European Journal of Applied Physiology, 106(5), 713-720.
Mounier R., Pialoux V., Schmitt L., Richalet J. P., Robach P., Coudert J., Clottes E., et al, Fellmann N.. 2009b;Effects of acute hypoxia tests on blood markers in high-level endurance athletes. European Journal of Applied Physiology 106(5):713–720. 10.1007/s00421-009-1072-z.Piehl-Aulin, K., Svedenhag, J., Wide, L., Berglund, B., & Saltin, B.(1998). Short-term intermittent normobaric hypoxia-haematological, physiological and mental effects. Scandinavian Journal of Medicine & Science in Sports, 8(3), 132-137.
Piehl-Aulin K., Svedenhag J., Wide L., Berglund B., et al, Saltin B.. 1998;Short-term intermittent normobaric hypoxia-haematological, physiological and mental effects. Scandinavian Journal of Medicine & Science in Sports 8(3):132–137.Puype, J., Van Proeyen, K., Raymackers, J. M., Deldicque, L., & Hespel, P. (2013). Sprint interval training in hypoxia stimulates glycolytic enzyme activity. Medicine and Science in Sports and Exercise, 45(11), 2166-2174.
Puype J., Van Proeyen K., Raymackers J. M., Deldicque L., et al, Hespel P.. 2013;Sprint interval training in hypoxia stimulates glycolytic enzyme activity. Medicine and Science in Sports and Exercise 45(11):2166–2174. 10.1249/mss.0b013e31829734ae.Richalet, J. P., & Gore, C. J. (2008). Live and/or sleep high: train low, using normobaric hypoxia. Scandinavian Journal of Medicine & Science in Sports, 18(suppl. S1), 29-37.
Richalet J. P., et al, Gore C. J.. 2008;Live and/or sleep high: train low, using normobaric hypoxia. Scandinavian Journal of Medicine & Science in Sports 18suppl. S1. :29–37. 10.1111/j.1600-0838.2008.00830.x.Robach, P., Schmitt, L., Brugniaux, J. V., Roels, B., Millet, G., Hellard, P., et al. (2006). Living high–training low: effect on erythropoiesis and aerobic performance in highly-trained swimmers. European Journal of Applied Physiology, 96(4), 423-433.
Robach P., Schmitt L., Brugniaux J. V., Roels B., Millet G., Hellard P.. et al 2006;Living high–training low: effect on erythropoiesis and aerobic performance in highly-trained swimmers. European Journal of Applied Physiology 96(4):423–433. 10.1007/s00421-005-0089-1.Rodriguez, F. A., Casas, H., Casas, M., Pages, T., Rama, R., Ricart, A., Ventura, J. L., Ibanez, J., & Viscor, G. (1999). Intermittent hypobaric hypoxia stimulates erythropoiesis and improves aerobic capacity. Medicine and Science in Sports and Exercise, 31(2), 264-268.
Rodriguez F. A., Casas H., Casas M., Pages T., Rama R., Ricart A., Ventura J. L., Ibanez J., et al, Viscor G.. 1999;Intermittent hypobaric hypoxia stimulates erythropoiesis and improves aerobic capacity. Medicine and Science in Sports and Exercise 31(2):264–268.Rusko, H. K., Tikkanen., H., Paavolainen., L., Hamalainen., I., Kalliokoski, K., & A. Puranen. (1999). Effects of living high in hypoxia and training in normoxia on sea level VO2max and red cell mass. Medicine and Science in Sports and Exercise. 31(suppl. 5): S86.
Rusko H. K., Tikkanen. H., Paavolainen. L., Hamalainen. I., Kalliokoski K., et al, Puranen. A.. 1999;Effects of living high in hypoxia and training in normoxia on sea level VO2max and red cell mass. Medicine and Science in Sports and Exercise 31(suppl. 5). :S86.Schmidt, W., Eckardt, K. U., Hilgendorf, A., & Bauer, C. (1991). Effects of Maximal and Submaximal Exercise under Normoxic and Hypoxic Conditions on Serum Erythropoietin Level. International Journal of Sports Medicine, 12(5), 457-461.
Schmidt W., Eckardt K. U., Hilgendorf A., et al, Bauer C.. 1991;Effects of Maximal and Submaximal Exercise under Normoxic and Hypoxic Conditions on Serum Erythropoietin Level. International Journal of Sports Medicine 12(5):457–461. 10.1055/s-2007-1024713.Schmutz, S., Dapp, C., Wittwer, M., Durieux, A. C., Mueller, M., Weinstein, F., Vogt, M., Hoppeler, H., Flück, M.(2010). A hypoxia complement differentiates the muscle response to endurance exercise. Experimental Physiology, 96(6), 723-735.
Schmutz S., Dapp C., Wittwer M., Durieux A. C., Mueller M., Weinstein F., Vogt M., Hoppeler H., Flück M.. 2010;A hypoxia complement differentiates the muscle response to endurance exercise. Experimental Physiology 96(6):723–735. 10.1113/expphysiol.2009.051029.Sheel, A. W., & MacNutt, M. J. (2008). Control of ventilation in humans following intermittent hypoxia. Applied Physiology, Nutrition, and Metabolism, 33(3), 573-581.
Sheel A. W., et al, MacNutt M. J.. 2008;Control of ventilation in humans following intermittent hypoxia. Applied Physiology, Nutrition, and Metabolism 33(3):573–581. 10.1139/h08-008.Spina, R. J., Chi, M. M., Hopkins, M. G., Nemeth, P. M., Lowry, O. H., & Holloszy, J. O. (1996). Mitochondrial enzymes increase in muscle in response to 7-10 days of cycle exercise. Journal of Applied Physiology, 80(6), 1985-2005.
Spina R. J., Chi M. M., Hopkins M. G., Nemeth P. M., Lowry O. H., et al, Holloszy J. O.. 1996;Mitochondrial enzymes increase in muscle in response to 7-10 days of cycle exercise. Journal of Applied Physiology 80(6):1985–2005. 10.1152/jappl.1996.80.6.2250.Terrasod, N., Jansson, E., Sylven, C., & Kaijser, L. (1990). Is hypoxia a stimulus for synthesis of oxidative enzymes and myoglobin? Journal of Applied Physiology, 68, 2369-2372.
Terrasod N., Jansson E., Sylven C., et al, Kaijser L.. 1990;Is hypoxia a stimulus for synthesis of oxidative enzymes and myoglobin? Journal of Applied Physiology 68:2369–2372.Townsend, N. E., Gore, C. J., Hahn, A. G., Aughey, R. J., Clark, S. A., Kinsman, T. A., McKenna, M. J., Hawley, J. A., & Chow, C. M. (2005). Hypoxic ventilatory response is correlated with increased submaximal exercise ventilation after live high, train low. European Journal of Applied Physiology, 94(1-2), 207-215.
Townsend N. E., Gore C. J., Hahn A. G., Aughey R. J., Clark S. A., Kinsman T. A., McKenna M. J., Hawley J. A., et al, Chow C. M.. 2005;Hypoxic ventilatory response is correlated with increased submaximal exercise ventilation after live high, train low. European Journal of Applied Physiology 94(1-2):207–215. 10.1007/s00421-004-1252-9.Van Proeyen, K., Szlufcik, K., Nielens, H., Ramaekers, M., & Hespel, P. (2011). Benefical metabolic adaptations due to endurance exercise training in the fasted state. Journal of Applied Physiology, 110(1), 236-245.
Van Proeyen K., Szlufcik K., Nielens H., Ramaekers M., et al, Hespel P.. 2011;Benefical metabolic adaptations due to endurance exercise training in the fasted state. Journal of Applied Physiology 110(1):236–245. 10.1152/japplphysiol.00907.2010.Weyand, P. G., Lee, C. S., Martinez-Ruiz, Ricardo, Bundle, M. W., Bellizzi, M. J., & Wright, S. (1999). High-speed running performance is largely unaffected by hypoxic reductions in aerobic power. Journal of Applied Physiology, 86, 2059-2064.
Weyand P. G., Lee C. S., Martinez-Ruiz Ricardo, Bundle M. W., Bellizzi M. J., et al, Wright S.. 1999;High-speed running performance is largely unaffected by hypoxic reductions in aerobic power. Journal of Applied Physiology 86:2059–2064. 10.1152/jappl.1999.86.6.2059.Zoll, J., Ponsot, E., Dufour, S., Doutreleau, S., Ventura-Clapier, R., Vogt, M., Hoppeler, H., Richard, R., Flück, M. (2006). Exercise training in normobaric hypoxia in endurance runners. III. Muscular adjustments of selected gene transcripts. Journal of Applied Physiology, 100, 1258-1266.
Zoll J., Ponsot E., Dufour S., Doutreleau S., Ventura- Clapier R., Vogt M., Hoppeler H., Richard R., Flück M.. 2006;Exercise training in normobaric hypoxia in endurance runners. III. Muscular adjustments of selected gene transcripts. Journal of Applied Physiology 100:1258–1266. 10.1152/japplphysiol.00359.2005.