트레드밀 운동과 밝은 빛이 흰쥐 뇌의 세로토닌 발현에 미치는 영향
Effects of Treadmill Exercise and Bright Light on Serotonin Expression in Rat Brain
Article information
Abstract
이 연구는 트레드밀 운동과 밝은 빛이 흰쥐 뇌의 세로토닌 발현에 미치는 영향을 조사하는데 그 목적이 있다. 수컷 흰쥐는 임의로 아홉 마리씩 네 집단(통제집단, 운동집단, 빛집단, 운동+빛집단)으로 분류하였다. 운동집단은 일주일에 5일, 하루에 30분씩 운동하였고, 빛집단은 일주일에 5일 하루에 30분씩 10,000 lux의 빛을 쬐었으며 운동+빛집단은 운동과 빛을 위 두 방식대로 복합처치 되었다. 실험기간은 4주간이며 통제집단은 아무런 실험처치 없이 사육되었다. 우리는 통제집단에 비해 나머지 집단에서 회봉선핵과 중뇌에서 세로토닌의 발현이 유의미하게 증가된 것을 알았다. 흥미로운 것은 세로토닌의 발현이 면역조직화학법에서 운동집단과 빛집단에 비해 운동+빛집단에서 유의미하게 증가된 것이고, 면역얼룩법에서도 유의미한 증가는 아니지만 증가의 양상을 보였다는 것이다. 결과적으로 트레드밀 운동과 밝은 빛은 뇌의 세로토닌 발현에 긍정적인 효과가 있음을 알 수 있었다. 그러므로 우리는 성장기에 밝은 빛을 쬐면서 운동을 하는 것은 뇌 활동에 도움이 될 것이라 제안한다.
Trans Abstract
The main purpose of this study was to investigate the effects of treadmill exercise and bright light exposure on serotonin expression in rat brain. Male Sprague-Dawley (SD) rats were randomly assigned into four groups (n=9 in each group), specifically, control group (CG), exercise group (EG), light group (LG), and exercise+light group (ELG). Rats in EG were subjected to treadmill exercise (5 days/week, 30 min/day), LG rats exposed (5 days/week, 30 min/day, 10,000 Lux), ELG rats subjected to treadmill exercise in combination with exposure, and CG rats remained sedentary over a four-week period. We observed a significant increase in serotonin expression in the raphe obscurus nucleu and the midbrain of rats in EG, LG, and ELG, compared to CG. Interestingly, serotonin expression was significantly increased in ELG, compared to EG and LG in the raphe obscurus nucleu via immunohistochemistry. In the western blot, it showed a increased pattern in ELG, compared to EG and LG. The overall results showed that treadmill exercise and/or bright light had positive effects on serotonin expression in the brain. Therefore, we suggest that moderate exercise or exposure to bright light during a growth child may be beneficial in brain action.
서 론
뇌의 신경세포들은 신경전달물질을 통해 서로 정보를 전달한다. 세로토닌이라는 신경전달물질은 19세기 중엽 혈액 속에서 근육을 강력히 수축하는 물질로 발견되었고 ‘혈액(sero)’으로부터 분리한 ‘활성물질(tonin)’이라는 의미에서 세로토닌(serotonin)이라는 이름이 붙었다(Watts & Davis, 2011; Watts et al., 2009). 세로토닌은 tryptophan hydroxylase 와 aromatic amino acid decarboxylase 의 두 단계의 과정을 요구하는 트립토판으로부터 합성되는 신경전달물질이다(Dankoski & Wightman, 2013).
세로토닌은 감정조절, 각성, 공격적 행동, 기억, 학습, 운동조절, 생물학적 리듬과 스트레스 반응과 관련되어 있다고 보고되고 있다(Zhou et al., 2001). 게다가, Svennignsson et al.(2006)은 세로토닌은 우울증, 강박장애, 약물 중독, 불안, 수면과도 관련이 있다고 보고하였다.
세로토닌은 노르에피네프린, 도파민 등과 함께 뇌의 중요한 신경계를 형성하고 있다. 고도의 정신 기능과 감정을 조절하는 정서 기능 등은 이들 신경계의 조절에 의해 이루어진다. 예를 들어 세로토닌 신경계의 기능이 약해지면 우울증이 나타난다(Neumeister et al., 2004).
현대 의학에서는 세로토닌 결핍을 완화하기 위해 투약치료나 전자 충격 치료법(Cusin & Dougherty, 2013)이 사용되기도 하나 이러한 물리적 치료방법은 부작용을 초래하는 경우가 발생하므로 운동과 햇빛이 매력적인 대안으로 제시되기도 한다(Finley & Lee, 2008; Schramm et al., 2001). 만약 운동과 햇빛이 반우울증 효과가 거의 없다고 하더라도 우울증 환자가 운동과 햇빛을 경험하면 그것들의 치료효과를 높이 평가한다는 사실은 매우 고무적이다. 그러나 운동과 햇빛이 정신 건강을 증진시키는 기전이 무엇인지 명확하게 밝혀내지 못하고 있다(Dunn & Dishman, 1991; Lee et al., 2013).
운동은 신경전달물질과의 관계를 검증(Weiss et al., 1975)하는 것부터 특정한 질병 치료의 목적(He et al., 2012; Renoir et al., 2011)에 이르기까지 폭넓게 연구되고 있다. 인체에 운동과 같은 신체적 자극이 주어지면, 세로토닌 같은 신경전달물질의 분비가 변화된다. 그것은 에너지 대사와 관련되었을 뿐만 아니라 항상성과 기분의 변화에도 영향을 미친다(Burchett & Hicks, 2006; Karlsson & Holmes, 2006). 운동을 하면 심장이 신체의 다른 부위 뿐만 아니라 뇌에도 많은 양의 혈액을 공급하는데 뇌로 보내진 혈액은 뇌세포에 영양을 공급하고 새로운 신경세포들을 생산해 낸다(Kwon et al., 2013). 다시 말해서, 운동은 뇌의 화학적 특성을 변화시켜 뇌 건강을 향상시키는 방법이 되는 것이다.
햇빛은 아주 중요한 물질임에 반해 사람들은 그 중요성을 인지하지 못하고 있다. 또한 피부와 관련된 질병이나 미를 위해 사람들은 햇빛 쬐는 것을 싫어한다. 하지만 햇빛 결핍은 다양한 질병을 야기시킨다(Dean, 2012; Laaksi, 2012). 또한 비타민 D의 생산을 촉진시키기 위해서도 햇빛은 인간에게 꼭 필요한 자원일 것이다(Yuen & Jablonski, 2010).
또한 빛은 눈을 통해 들어가 뇌의 생화학적 변화를 야기시켜 이상 증상을 교정시킬 수 있으므로 계절정서장애(Sanassi, 2014), 항우울증 치료(Oldham & Ciraulo, 2014) 및 치매노인의 격앙행동 및 수면장애에 대한 중재 방법(McCurry et al., 2011; Mishima, 2012)으로 연구가 시도되고 있다. 그렇다면 빛은 뇌의 신경전달물질에 영향을 주어 뇌의 생화학 작용 및 뇌 생리에 관여하여 감정, 각성, 행동, 수면 등에 영향을 미칠 것이다. 또한 바깥활동이 적어 빛에 노출이 적은 요즘 아이들에게 빛의 효과를 검정하는 것은 의미있는 일 일 것이다.
따라서 본 연구는 트레드밀 운동과 밝은 빛에 의한 세로토닌의 발현 변화를 회봉선핵(raphe obscurus nucleu)과 안구 운동과 홍채 조절의 역할을 하는 중뇌(Huber, 1982)에서 관찰하여 운동과 빛이 뇌 활동을 활발히 하여 우울증 및 정서안정에 도움이 될 수 있다는 근거를 제공하기 위해 수행되었다. 또한 선행연구들은 운동과 빛의 단독 처치에 대한 결과들이고 본 연구에서는 운동과 빛을 복합 처치했을 때 부가적인 결과가 있는지에 대해 확인하였다.
연구방법
연구대상
본 연구의 실험동물은 생후 5주령 된 체중 160±10g의 수컷 Sprague-Dawley 계열의 흰쥐(KOATECH, Korea) 36마리를 사용하였다. 집단분류는 무작위 표본추출에 의하여 통제집단(n=9), 운동집단(n=9), 빛집단(n=9), 그리고 운동+빛집단(n=9)으로 분류하였다.
실험동물은 실험 전 일주일 동안 실험실 환경 적응 기간을 거치게 하였다. 3마리당 한 개의 사육케이스(28㎝×42㎝×20㎝)에 넣고 항온(22±2℃), 항습(60±10%)을 유지하고 12시간 간격으로 낮과 밤을 교대시키는 동일한 환경으로 G대학의 청정동물실에서 사육되었으며 모든 실험 절차는 동물실험 윤리위원회의 승인을 받았다.
트레드밀 운동방법
운동을 필요로 한 집단은 소형동물용 트레드밀(PARK TECH, Korea)에서 산소섭취량의 항정상태를 유지하기 위해 점증적인 부하를 이용하여 운동하도록 하였다(Takatsu et al., 2010; Tuan et al., 2008). 점증부하 운동수행은 경사도 0°에서 초기 5분간은 2m/min 속도로 부하 하다가 그 다음 5분간은 5m/min 속도로, 그리고 8m/min 속도에서 20분간, 하루 일회씩 총 30분간 달리기 운동을 일주일에 5일, 4주간 실시하였다. 4주간의 실험처치와 위와 같은 트레드밀 속도 및 경사도는 흰쥐 뇌에서 신경세포 생성 및 신경 변화에 영향을 미치는 기간과 운동 강도로 분류된다(Kim et al., 2003; Kwon et al., 2013).
인공 광램프에 노출
본 연구를 위한 인공 광램프(Philips, Poland)는 조도 10,000 Lux까지 낼 수 있는 백광색 조명기기로 태양광 대비 91%에 근접하는 인공태양근접광원이다. 빛 치료의 목적으로는 일반적으로 10,000 Lux의 광원에 노출하므로(Gagné et al., 2007), 사용방법에 따라 인공 광램프를 실험동물로부터 80㎝의 거리에 두고 사용하였다. 하루 일회 광원 노출 시간과 실험처치 기간은 운동을 시킨 집단과 동일하며 운동+빛집단은 광원을 쬐면서 운동을 동시에 실시하였다.
뇌 적출 및 조직처리
실험동물은 각 집단별 4마리씩은 면역조직화학법(immunohistochemistry)용으로 5마리씩은 면역얼룩법(immunoblot)용으로 사용하였다.
면역조직화학법용 실험동물은 실험 종료 24시간 후 고통을 최소화 하기 위해 Zoletil 50Ⓡ(10mg/kg)을 복강 내 주사를 통하여 마취시켰다. 그 다음 흉강을 열고 좌심실을 통하여 0.1M 인산염 완충식염수(phosphate buffer saline, PBS)를 주입하여 혈액을 제거하고 4℃에 보관한 4%의 NBP(neutralize buffered paraformaldehyde) 고정액을 관류하였다. 관류 고정 후 뇌를 적출한 다음 고정액에 담가 4℃에서 48시간 후고정을 실시하였다. 고정된 뇌 조직은 20% sucrose 용액에서 하루간 침전시킨 후 액체질소와 Isopentane을 이용하여 O.C.T.(Optimal Cutting Temperature)화합물(compound)로 냉동시킨 후 -80℃ 냉동고에 조직을 보관하였다. -80℃에 보관된 조직은 냉동 조직 절편기(Freezing microtome)의 작업온도와 맞추기 위해 -20℃ 냉동고로 옮겨서 1시간 후 냉동 조직 절편기를 이용하여 30㎛ 두께의 연속관상 절편을 제작하여 저장용액에 담가 -20℃ 냉동고에 보관하였다.
면역얼룩법용 실험동물은 실험 종료 48시간 후 Zoletil 50Ⓡ(10mg/kg)을 복강 내 주사를 통하여 마취시키고 단두하여 뇌 조직의 중뇌(midbrain)를 떼어내어 액체질소에 급냉동시켜 –80℃ 냉동고에 보관하였다.
면역조직화학법(Immunohistochemistry)
면역조직화학법은 자유부유법(free-floating)을 이용하였다. Triton X-100으로 10분간 세척한 후 조직내에 존재하는 내재성 peroxidase를 비활성화 시키기 위해서 0.1M PBS에 과산화수소(H2O2)를 0.3%로 희석하여 10분간 반응시켰다. 그리고나서 1.5% Blocking Solution에 30분간 반응시켰다. 그 다음 신경전달물질들의 활성도를 검출하기 위해 TPH 1차 항체(1:50, mouse monoclonal primary antibody, Sigma, USA)를 4℃ 냉장고에서 하루 동안 반응시켰다. 1차 항체용액에서의 반응이 끝난 다음, 2차 항체용액(1:200, secondary biotinylated IgG, Vector, USA)을 1시간 동안 실온에서 반응시켰다. 세척한 후 avidine-biotin-peroxidase complex(ABC kit, Vector, USA)에서 1시간 동안 실온에서 반응시켰다. 발색제로는 3,3‘-diaminobenzidine tetrahydrochlo ride(DAB)를 0.1M PBS에 0.03%로 희석하여 여과(filter)하였고, 사용전 0.003% 과산화수소(H2O2)를 첨가하였다. 발색반응은 상온에서 3분간 발색시키고 세척 후 조직을 젤라틴으로 코팅된 슬라이드에 얹어서 상온에서 하룻밤(overnight)동안 건조시켰다. 건조시킨 후 에탄올(ethanol)의 농도를 70%, 80%, 90%, 95%, 100%로 단계적으로 높여가며 탈수시키고 자일렌(xylene)으로 투명화 작업을 거쳐 고정(mounting)용액으로 커버슬라이드를 올려 봉입하였다.
면역얼룩법(Immunoblot: Western blot)
냉동고에 보관된 조직을 PIC용액과 lysis buffer (1:100)로 녹이고 2분씩 2∼3번 초음파분해(sonication)하였다. 4℃에서 12,000rpm으로 35분간 원심 분리(centrifugation)한 후 상청액을 새로운 tube에 옮겨 단백질을 정량하였다. 정량된 단백질을 이용하여 8% SDS-polyacrylamine gel에서 전기영동하였다. 그 후 5% SM(skim milk) TBST로 상온에서 2시간 blocking하였다. blocking 후 1차 항체를 3% SM TBST와 1:500으로 희석하여 4℃ 냉장고에서 하룻밤(overnight) 동안 반응시켰다. 다음으로 2차 항체(goat anti-mouse, Thermo Scientific, USA)를 2.5% SM(skim milk) TBST와 1:10,000으로 희석하여 상온에서 2시간 동안 반응시켰다. ECL(enhanced chemiluminescence) 용액과 LAS-4000(Fujifilm, Japan)을 이용하여 사진현상을 하였다. 밴드의 크기를 동일 조건으로 비교하기 위해 α-tubulin을 통해 확인하였다.
조직 관찰 및 양성 세포수 측정
TPH 양성세포는 뇌의 회봉선핵(raphe obscurus nucleu)에서 발색제인 DAB에 의해 갈색으로 나타나며 이러한 반응을 나타낸 세포체나 신경섬유와 뇌 조직 각 부위의 염색성 등을 광학현미경으로 관찰하였다. 각 효소의 양성세포수는 Image-Pro Plus 6.1프로그램(Media Cybernetics, USA)을 이용하여 조직절편(section)당 정량적으로 분석하였다. 뇌의 각 부위의 위치와 명칭은 Paxinos와 Watson(1986)의 도해서(atlas)를 참고하였다.
자료처리 및 분석
측정된 자료는 SPSS Win 17.0 프로그램을 이용하여 통계처리 하였다. 기술통계학적 분석을 통해 측정된 각 집단의 평균(mean) 및 표준오차(standard error mean; S.E.M.)를 산출하였다. 본 연구에서는 집단 간에 따른 종속 변인인 세로토닌 발현의 차이를 알아보기 위하여 일원분산분석(one-way ANOVA)을 실시하였다. 또한 Scheffe's method를 이용하여 사후검정을 실시하였고, 유의수준은 .05로 설정하였다.
결 과
뇌의 회봉선핵에서 TPH 양성세포수의 변화
트레드밀 운동과 빛에 노출이 뇌의 회봉선핵(raphe obscurus nucleu)에서 세로토닌 합성효소인 TPH (Tryptophan Hydroxylase)의 발현에 어떠한 영향을 미치는지 확인하기 위해 면역조직화학법을 수행하였다. 모든 집단에서 TPH 양성 세포는 개별적으로 또는 몇 개가 한 무리를 이룬 양상으로 관찰되었다(그림 1A).
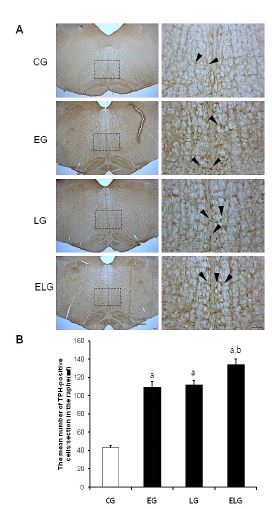
회봉선핵에서의 TPH 양성세포의 현미경 사진(A) 및 분석 그래프(B)
ap<.001, vs. CG; bp<0.001, vs. EG & LG, CG:통제집단, EG:운동집단, LG:빛집단, ELG:운동+빛집단
회봉선핵에서의 TPH 양성 세포수는 통제집단 42.75±2.91/㎟, 운동집단 109.25±6.44/㎟, 빛집단 111.88±4.60/㎟, 운동+빛집단 133.88±6.25/㎟으로 나타났으며, 집단간 차이를 비교하기 위한 그래프는 <그림 1B>와 같다.
<그림 1B>에 나타난 바와 같이 각 집단간 통계적 유의성을 검증한 결과 TPH 양성 세포수의 유의한 차이가 있었으며(p<.001), 사후 검정 결과, 통제집단에 비해 다른 모든 집단에서 유의한 증가를 보였고 운동+빛집단은 운동집단과 빛집단에 비해서도 유의한 증가를 보였다.
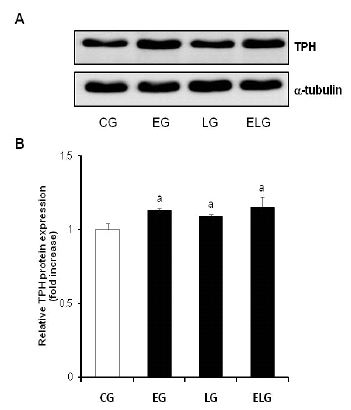
중뇌(midbrain)에서의 TPH 단백질 수준의 변화
트레드밀 운동과 빛에 노출이 중뇌에서 TPH 단백질의 발현에 어떠한 영향을 미치는지 확인하기 위해 면역얼룩법(Western blotting analysis)을 수행하였다(그림 2A).
TPH 단백질 발현의 측정 결과 통제집단 1.00±.04, 운동집단 1.13±.01, 빛집단 1.09±.01, 운동+빛집단 1.15±.07로 나타났으며, 집단간 차이를 비교하기 위한 그래프는 <그림 2B>와 같다.
<그림 2B>에 나타난 바와 같이 각 집단간 통계적 유의성을 검증한 결과 TPH 단백질 발현에 유의한 차이가 있었으며(p<.01), 사후 검정 결과, 통제집단에 비해 다른 모든 집단에서 유의한 증가를 보였지만 운동+빛집단이 운동집단과 빛집단에 비해 증가한 양상은 보이나 통계적으로 유의하지는 않았다.
논 의
이 연구에서는 Sprague-Dawley계열의 수컷 흰쥐를 대상으로 4주간 트레드밀 운동과 밝은 빛에 노출이 뇌의 세로토닌 발현에 미치는 영향을 알아보고자 면역조직화학법과 면역얼룩법을 통해 그 결과를 확인하였으며, 본 연구에서 얻은 결과를 이미 수행된 선행 연구결과와 비교하여 고찰하였다.
TPH(Tryptophan Hydroxylase)는 뇌의 봉선핵에서 세로토닌 합성의 속도 조절 효소이고, 세로토닌 합성에 특이성을 가지며 세로토닌 형성 세포에만 존재하는 것으로 알려져있다(Blomstrand, 2001; Struder & Weicker, 2001). 즉, TPH의 활성은 세로토닌의 생산과 방출량을 조절하는 것이다. 또한 TPH는 세로토닌의 합성뿐만 아니라 기능까지도 조절하는 것으로 알려져 있다(Gartside et al., 1992).
봉선핵에서 방출되는 세로토닌 신경섬유는 해마 및 대뇌피질에까지 퍼져있다(Malagie et al., 1995). 세로토닌은 행동, 생리학적 메카니즘, 질병 과정과 관련되어 있고(Azmitia, 2001), 체온(Figgitt, & McClellan, 2000), 혈압(Watts et al., 2012), 내분비 활성, 식욕(Papazoglou et al., 2012), 성행동, 운동, 공격성(Duke et al., 2013) 등을 조절하며, 기억과 인지(Horisawa et al., 2013), 뇌의 발달과 성숙(Dubovsky, 1994)에도 관여하는 것으로 알려져 있다. 이처럼 세로토닌이 신체의 생리적 변화에 많은 영향을 끼치듯이 운동과 빛에 의한 세로토닌의 발현 변화를 관찰한 본 연구 결과로 보아 운동과 빛은 신체의 생리적 변화 및 뇌 활동의 활성화에 긍정적 영향을 미칠 것이라 생각된다.
뇌에서 세로토닌의 발현에 있어 운동의 효과는 잘 알려져있다(Baek et al., 2012; Langfort et al., 2006; Lim et al., 2001; MacGillivray et al., 2012). 운동은 여러 뇌 부위의 세로토닌 방출을 자극하고(Kirby et al., 1995), 봉선핵은 세로토닌 중추 분비의 조절자로서 뇌의 여러 부위에서 세로토닌 방출을 조절한다(Graeff, 1997). 이러한 연구 결과들은 운동집단과 운동+빛집단에서 세로토닌의 발현이 유의하게 증가한 본 연구 결과와 일치한다. Ursin(2002)은 봉선핵에서 세로토닌 방출은 수면과 걷기 단계에서 차이가 나타난다고 보고하였는데, 이는 세로토닌이 유산소성 운동과 빛의 조사량과 깊은 관련이 있다는 것으로 해석할 수 있으며 본 연구 결과를 잘 뒷받침해준다. 또한, Pjrek et al.(2005)은 계절성 정서 장애는 우울증 장애의 일반적인 변형이며 이는 밝은 빛 치료로 개선될 수 있음을 보고하면서 세로토닌 시스템이 항우울제보다 낫다고 하여 우울증 치료에 빛의 필요성을 제시하였다. 또한 계절 정서 장애에서 세로토닌의 역할에서 가장 자연스런 치료방법은 빛 치료라고 제시하였고(Gupta et al., 2013), 빛 치료는 일반적으로 1~2주 처치 후 임상적 향상이 있었다고 보고하였다(Kurlansik & Ibay, 2012). 또한 6주 동안 어둠에 방치한 쥐에게서 세로토닌성 신경 세포 자멸사가 증가하는 연구결과(Gonzalez & Aston-Jones, 2008)로 보아 빛과 세로토닌 시스템은 매우 밀접한 관련이 있음을 알 수 있다.
회봉선핵에서 TPH의 발현을 본 본 연구에서는 통제집단에 비해 운동집단, 빛집단 및 운동+빛집단에서 통계적으로 유의한 증가가 있었고 흥미롭게도 운동과 빛을 복합 처치한 집단에서는 운동집단과 빛집단에 비해 유의한 증가가 있었다. 이는 망막을 통해 빛이 들어오면 봉선핵에서 세로토닌의 발현을 직접적으로 자극하기 때문에 운동과 빛의 효과가 그대로 나타난 것이라 생각된다. 또한, 중뇌에서도 TPH 단백질 발현은 통제집단에 비해서 나머지 모든 집단에서 유의한 증가가 있었다. 하지만 예상과 달리 운동집단, 빛집단, 운동+빛집단간에는 유의한 차이가 없었다. 이는 야행성 동물은 주행성 동물과 달리 밝은 빛에서는 휴식을 취해야 하는데 강제로 트레드밀 운동을 시킴으로써 스트레스가 안구운동과 홍채 조절에 관여하여 서로의 효과를 상쇄시켰을 것이라 생각한다. 그러나 운동과 빛을 복합 처치한 집단에서 가장 큰 증가를 볼 수 있었다. 이처럼 운동과 빛은 세로토닌성 시스템을 개선시켜 뇌의 기능을 향상시킬 수 있을 것이라 생각된다. 또한 세로토닌이 수면과 관련이 있듯이 운동이나 빛, 그리고 빛을 쬐면서 운동하는 것은 세로토닌의 발현을 증가시켜 낮에는 활동을 왕성하게 하고 밤에는 깊이 잠을 자는 일주기 리듬을 개선하고 우울증 또한 감소시킬 수 있을 것이라 생각된다. 또한 본 실험 결과로 보아 밝은 빛 아래에서 운동을 하는 것은 뇌 건강을 위해 도움이 될 것이라 생각된다. 하지만 밝은 빛이라도 고온 환경에서는 신경세포 생성을 억제하고 기억력을 감소시킬 수 있으므로(서진희 등, 2009) 운동 환경을 잘 설정하여야 할 것이다.
결 론
이 연구는 5주령된 Sprague Dawley계 수컷 흰 쥐를 대상으로 4주간의 트레드밀 운동과 밝은 빛에 노출하여 면역조직화학법과 면역얼룩법을 통해 뇌에서 세로토닌 발현에 미치는 영향을 알아본 결과 다음과 같은 결론을 얻었다.
1. 회봉선핵(raphe obscurus nucleu)에서 세로토닌의 발현은 통제집단에 비해 운동집단, 빛집단, 운동+빛집단에서 유의하게 증가하였고, 운동+빛집단은 운동집단과 빛집단에 비해 유의하게 증가하였다.
2. 중뇌(midbrain)에서 세로토닌의 발현은 통제집단에 비해 운동집단, 빛집단, 운동+빛집단에서 유의하게 증가하였고, 운동+빛집단은 운동집단과 빛집단에 비해 증가하는 양상은 보이나 유의한 차이는 없었다.
따라서, 유산소성 트레드밀 운동과 밝은 빛은 세로토닌의 발현을 증가시키는 긍정적인 효과가 있는 것으로 나타났다. 이로써 운동과 밝은 빛은 뇌를 활성화하여 우울증을 개선하고 불안증을 해소하는데 도움을 줄 수 있을 것이라 생각된다. 또한 운동과 빛은 뇌의 활동과 발달에 중요하다고 생각되며 어두운 조명에서 벗어나 밝은 자연의 빛을 받으며 적당한 운동을 선택하여 꾸준히 실행할 것을 제안한다.
References
서진희, 신말순, 김창주, 이광식, 임백빈(2009). 고온 환경에서의 트레드밀 운동이 흰쥐 뇌에서 세로토닌 발현, 신경세포 생성, 그리고 단기 기억력에 미치는 영향. 체육과학연구. 20(4). 743-754.
서 진희, 신 말순, 김 창주, 이 광식, 임 백빈. 2009;고온 환경에서의 트레드밀 운동이 흰쥐 뇌에서 세로토닌 발현, 신경세포 생성, 그리고 단기 기억력에 미치는 영향. 체육과학연구 20(4):743–754.Azmitia, E. C. (2001). Modern views on an ancient chemical: serotonin effects on cell proliferation, maturation, and apoptosis. Brain Research Bulletin, 56(5), 413-424.
Azmitia E. C.. 2001;Modern views on an ancient chemical: serotonin effects on cell proliferation, maturation, and apoptosis. Brain Research Bulletin 56(5):413–424. 10.1016/s0361-9230(01)00614-1.Baek, S. S., Jun, T. W., Kim, K. J., Shin, M. S., Kang, S. Y., & Kim, C. J. (2012). Effects of postnatal treadmill exercise on apoptotic neuronal cell death and cell proliferation of maternal-separated rat pups. Brain & Development, 34(1), 45-56.
Baek S. S., Jun T. W., Kim K. J., Shin M. S., Kang S. Y., et al, Kim C. J.. 2012;Effects of postnatal treadmill exercise on apoptotic neuronal cell death and cell proliferation of maternal-separated rat pups. Brain & Development 34(1):45–56. 10.1016/j.braindev.2011.01.011.Blomstrand, E. (2001). Amino acids and central fatigue. Amino Acids, 20(1), 25-34.
Blomstrand E.. 2001;Amino acids and central fatigue. Amino Acids 20(1):25–34. 10.1007/s007260170063.Burchett, S. A., & Hicks, T. P. (2006). The mysterious trace amines: protean neuromodulators of synaptic transmission in mammalian brain. Progress in Neurobiology, 79(5-6), 223-246.
Burchett S. A., et al, Hicks T. P.. 2006;The mysterious trace amines: protean neuromodulators of synaptic transmission in mammalian brain. Progress in Neurobiology 79(5-6):223–246. 10.1016/j.pneurobio.2006.07.003.Cusin, C., & Dougherty, D. D. (2013). Correction: Somatic therapies for treatment-resistant depression: ECT, TMS, VNS, DBS. Biology of Mood & Anxiety Disorders, 3(1), 1.
Cusin C., et al, Dougherty D. D.. 2013;Correction: Somatic therapies for treatment-resistant depression: ECT, TMS, VNS, DBS. Biology of Mood & Anxiety Disorders 3(1):1.Dankoski, E. C., & Wightman, R. M. (2013). Monitoring serotonin signaling on a subsecond time scale. Frontiers in Integrative Neuroscience, 7, 44.
Dankoski E. C., et al, Wightman R. M.. 2013;Monitoring serotonin signaling on a subsecond time scale. Frontiers in Integrative Neuroscience 7:44. 10.3389/fnint.2013.00044.Dean, E. (2012). Time to see the light. Nursing Standard, 26(31), 20-21.
Dean E.. 2012;Time to see the light. Nursing Standard 26(31):20–21.Dubovsky, S. L. (1994). Beyond the serotonin reuptake inhibitors: rationales for the development of new serotonergic agents. The Journal of Clinical Psychiatry, 55, 34-44.
Dubovsky S. L.. 1994;Beyond the serotonin reuptake inhibitors: rationales for the development of new serotonergic agents. The Journal of Clinical Psychiatry 55:34–44.Duke, A. A., Begue, L., Bell, R., & Eisenlohr-Moul, T. (2013). Revisiting the serotonin-aggression relation in humans: A meta-analysis. Psychological Bulletin, 139(5), 1148-1172.
Duke A. A., Begue L., Bell R., et al, Eisenlohr-Moul T.. 2013;Revisiting the serotonin-aggression relation in humans: A meta-analysis. Psychological Bulletin 139(5):1148–1172. 10.1037/a0031544.Dunn, A. L., & Dishman, R. K. (1991). Exercise and the neurobiology of depression. Exercise and Sport Sciences Reviews, 19, 41-98.
Dunn A. L., et al, Dishman R. K.. 1991;Exercise and the neurobiology of depression. Exercise and Sport Sciences Reviews 19:41–98. 10.1249/00003677-199101000-00002.Figgitt, D. P., & McClellan, K. J. (2000). Fluvoxamine. An updated review of its use in the management of adults with anxiety disorders. Drugs, 60(4), 925-954.
Figgitt D. P., et al, McClellan K. J.. 2000;Fluvoxamine. An updated review of its use in the management of adults with anxiety disorders. Drugs 60(4):925–954.Finley, P. R., & Lee, K. C. (2008). Applied therapeutics: the clinical use of drugs(9th ed.). Philadelphia: Wolters Kluwer.
Finley P. R., et al, Lee K. C.. 2008. Applied therapeutics: the clinical use of drugs(9th ed.) Philadelphia: Wolters Kluwer.Gagné, A. M., Gagné, P., & Hébert, M. (2007). Impact of light therapy on rod and cone functions in healthy subjects. Psychiatry Research, 151(3), 259-263.
Gagné A. M., Gagné P., et al, Hébert M.. 2007;Impact of light therapy on rod and cone functions in healthy subjects. Psychiatry Research 151(3):259–263. 10.1016/j.psychres.2006.09.004.Gartside, S. E., Cowen, P. J., & Sharp, T. (1992). Evidence that the large neutral amino acid L-valine decreases electrically-evoked release of 5-HT in rat hippocampus in vivo. Psychopharmacology, 109(1-2), 251-253.
Gartside S. E., Cowen P. J., et al, Sharp T.. 1992;Evidence that the large neutral amino acid L-valine decreases electrically-evoked release of 5-HT in rat hippocampus in vivo. Psychopharmacology 109(1-2):251–253. 10.1007/bf02245511.Gonzalez, M. M., & Aston-Jones, G. (2008). Light deprivation damages monoamine neurons and produces a depressive behavioral phenotype in rats. Proceedings of the National Academy Sciences, 105(12), 4898-4903.
Gonzalez M. M., et al, Aston-Jones G.. 2008;Light deprivation damages monoamine neurons and produces a depressive behavioral phenotype in rats. Proceedings of the National Academy Sciences 105(12):4898–4903. 10.1073/pnas.0703615105.Graeff, F. G. (1997). Serotonergic systems. The Psychiatric Clinics North America, 20(4), 723-739.
Graeff F. G.. 1997;Serotonergic systems. The Psychiatric Clinics North America 20(4):723–739. 10.1016/s0193-953x(05)70342-7.Gupta, A., Sharma, P. K., Garg, V. K., Singh, A. K., & Mondal, S. C. (2013). Role of serotonin in seasonal affective disorder. European Review for Medical and Pharmacological Sciences, 17(1), 49-55.
Gupta A., Sharma P. K., Garg V. K., Singh A. K., et al, Mondal S. C.. 2013;Role of serotonin in seasonal affective disorder. European Review for Medical and Pharmacological Sciences 17(1):49–55.He, S. B., Tang, W. G., Tang, W. J., Kao, X. L., Zhang, C. G., & Wong, X. T. (2012). Exercise intervention may prevent depression. International Journal of Sports Medicine, 33(7), 525-530.
He S. B., Tang W. G., Tang W. J., Kao X. L., Zhang C. G., et al, Wong X. T.. 2012;Exercise intervention may prevent depression. International Journal of Sports Medicine 33(7):525–530. 10.1055/s-0032-1306325.Horisawa, T., Nishikawa, H., Toma, S., Ikeda, A., Horiguchi, M., Ono, M., Ishiyama, T., & Taiji, M. (2013). The role of 5-HT(7) receptor antagonism in the amelioration of MK-801-induced learning and memory deficits by the novel atypical antipsychotic drug lurasidone. Behavioural Brain Research, 244, 66-69.
Horisawa T., Nishikawa H., Toma S., Ikeda A., Horiguchi M., Ono M., Ishiyama T., et al, Taiji M.. 2013;The role of 5-HT(7) receptor antagonism in the amelioration of MK-801-induced learning and memory deficits by the novel atypical antipsychotic drug lurasidone. Behavioural Brain Research 244:66–69. 10.1016/j.bbr.2013.01.026.Huber, A. (1982). Walter Rudolf Hess as an ophthalmologist. Gesnerus, 39(2), 287-293.
Huber A.. 1982;Walter Rudolf Hess as an ophthalmologist. Gesnerus 39(2):287–293.Karlsson, R. M., & Holmes, A. (2006). Galanin as a modulator of anxiety and depression and a therapeutic target for affective disease. Amino Acids, 31(3), 231-239.
Karlsson R. M., et al, Holmes A.. 2006;Galanin as a modulator of anxiety and depression and a therapeutic target for affective disease. Amino Acids 31(3):231–239. 10.1007/s00726-006-0336-8.Kim, Y. P., Kim, H. B., Jang, M. H., Lim, B. V., Kim, Y. J., Kim, H., Kim, S. S., Kim, E. H., & Kim, C. J. (2003). Magnitude and time dependence of the effect of treadmill exercise on cell proliferation in the dentate gyrus of rats. International Journal of Sports Medicine, 24(2), 114-117.
Kim Y. P., Kim H. B., Jang M. H., Lim B. V., Kim Y. J., Kim H., Kim S. S., Kim E. H., et al, Kim C. J.. 2003;Magnitude and time dependence of the effect of treadmill exercise on cell proliferation in the dentate gyrus of rats. International Journal of Sports Medicine 24(2):114–117. 10.1055/s-2003-38202.Kirby, L. G., Allen, A. R., & Lucki, I. (1995). Regional differences in the effects of forced swimming on extracellular levels of 5-hydroxytryptamine and 5-hydroxyindoleacetic acid. Brain Research, 682(1-2), 189-196.
Kirby L. G., Allen A. R., et al, Lucki I.. 1995;Regional differences in the effects of forced swimming on extracellular levels of 5-hydroxytryptamine and 5-hydroxyindoleacetic acid. Brain Research 682(1-2):189–196. 10.1016/0006-8993(95)00349-u.Kurlansik, S. L., & Ibay, A. D. (2012). Seasonal affective disorder. American Family Physician, 86(11), 1037-1041.
Kurlansik S. L., et al, Ibay A. D.. 2012;Seasonal affective disorder. American Family Physician 86(11):1037–1041.Kwon, S. J., Park, J. S., Park, S. Y., Song, K. S., Jung, S. T., Jung, S. B., Park, I. R., Choi, W. S., & Kwon, S. O. (2013). Low-intensity treadmill exercise and/or bright light promote neurogenesis in adult rat brain. Neural Regeneration Research, 8(10), 922-929.
Kwon S. J., Park J. S., Park S. Y., Song K. S., Jung S. T., Jung S. B., Park I. R., Choi W. S., et al, Kwon S. O.. 2013;Low-intensity treadmill exercise and/or bright light promote neurogenesis in adult rat brain. Neural Regeneration Research 8(10):922–929.Laaksi, I. (2012). Vitamin D and respiratory infection in adults. The Proceedings of the Nutrition Society, 71(1), 90-97.
Laaksi I.. 2012;Vitamin D and respiratory infection in adults. The Proceedings of the Nutrition Society 71(1):90–97. 10.1017/s0029665111003351.Langfort, J., Baranczuk, E., Pawlak, D., Chalimoniuk, M., Lukacova, N., Marsala, J., & Górski, J. (2006). The effect of endurance training on regional serotonin metabolism in the brain during early stage of detraining period in the female rat. Cellular and Molecular Neurobiology, 26(7-8), 1327-1342.
Langfort J., Baranczuk E., Pawlak D., Chalimoniuk M., Lukacova N., Marsala J., et al, Górski J.. 2006;The effect of endurance training on regional serotonin metabolism in the brain during early stage of detraining period in the female rat. Cellular and Molecular Neurobiology 26(7-8):1327–1342. 10.1007/s10571-006-9065-5.Lee, H., Ohno, M., Ohta, S., & Mikami, T. (2013). Regular moderate or intense exercise prevents depression-like behavior without change of hippocampal tryptophan content in chronically tryptophan-deficient and stressed mice. Plos One, 8(7), e66996.
Lee H., Ohno M., Ohta S., et al, Mikami T.. 2013;Regular moderate or intense exercise prevents depression-like behavior without change of hippocampal tryptophan content in chronically tryptophan-deficient and stressed mice. Plos One 8(7):e66996. 10.1371/journal.pone.0066996.Lim, B. V., Jang, M. H., Shin, M. C., Kim, H. B., Kim, Y. J., Kim, Y. P., Chung, J. H., Kim, H., Shin, M. S., Kim, S. S., Kim, E. H., & Kim, C. J. (2001). Caffeine inhibits exercise-induced increase in tryptophan hydroxylase expression in dorsal and median raphe of Sprague-Dawley rats. Neuroscience Letters, 308(1), 25-28.
Lim B. V., Jang M. H., Shin M. C., Kim H. B., Kim Y. J., Kim Y. P., Chung J. H., Kim H., Shin M. S., Kim S. S., Kim E. H., et al, Kim C. J.. 2001;Caffeine inhibits exercise-induced increase in tryptophan hydroxylase expression in dorsal and median raphe of Sprague-Dawley rats. Neuroscience Letters 308(1):25–28. 10.1016/s0304-3940(01)01980-2.MacGillivray, L., Reynolds, K. B., Rosebush, P. I., & Mazurek, M. F. (2012). The comparative effects of environmental enrichment with exercise and serotonin transporter blockade on serotonergic neurons in the dorsal raphe nucleus. Synapse, 66(5), 465-470.
MacGillivray L., Reynolds K. B., Rosebush P. I., et al, Mazurek M. F.. 2012;The comparative effects of environmental enrichment with exercise and serotonin transporter blockade on serotonergic neurons in the dorsal raphe nucleus. Synapse 66(5):465–470. 10.1002/syn.21511.Malagie, I., Trillat, A. C., Jacquot, C., & Gardier, A. M. (1995). Effects of acute fluoxetine on extracellular serotonin levels in the raphe: an in vivo microdialysis study. European Journal Pharmacology, 286(2), 213-217.
Malagie I., Trillat A. C., Jacquot C., et al, Gardier A. M.. 1995;Effects of acute fluoxetine on extracellular serotonin levels in the raphe: an in vivo microdialysis study. European Journal Pharmacology 286(2):213–217.McCurry, S. M., Pike, K. C., Vitiello, M. V., Logsdon, R. G., Larson, E. B., & Teri, L. (2011). Increasing walking and bright light exposure to improve sleep in community-dwelling persons with Alzheimer's disease: results of a randomized, controlled trial. Journal of the American Geriatrics Society, 59(8), 1393-402.
McCurry S. M., Pike K. C., Vitiello M. V., Logsdon R. G., Larson E. B., et al, Teri L.. 2011;Increasing walking and bright light exposure to improve sleep in community-dwelling persons with Alzheimer's disease: results of a randomized, controlled trial. Journal of the American Geriatrics Society 59(8):1393–402. 10.1111/j.1532-5415.2011.03519.x.Mishima, K. (2012). Sleep disorders and sleep medicine in demented patients. Seishin Shinkeigaku Zasshi, 114(2), 167-170.
Mishima K.. 2012;Sleep disorders and sleep medicine in demented patients. Seishin Shinkeigaku Zasshi 114(2):167–170.Neumeister, A., Young, T., & Stastny, J. (2004). Implications of genetic research on the role of the serotonin in depression: emphasis on the serotonin type 1A receptor and the serotonin transporter. Psychopharmacology, 174(4), 512-524.
Neumeister A., Young T., et al, Stastny J.. 2004;Implications of genetic research on the role of the serotonin in depression: emphasis on the serotonin type 1A receptor and the serotonin transporter. Psychopharmacology 174(4):512–524. 10.1007/s00213-004-1950-3.Oldham, M. A., & Ciraulo, D. A. (2014). Bright light therapy for depression: A review of its effects on chronobiology and the autonomic nervous system. Chronobiology International, 31(3), 305-319.
Oldham M. A., et al, Ciraulo D. A.. 2014;Bright light therapy for depression: A review of its effects on chronobiology and the autonomic nervous system. Chronobiology International 31(3):305–319. 10.3109/07420528.2013.833935.Papazoglou, D., Restas, E., Papanas, N., Papatheodorou, K., Babouris, C., Glaros D., Antonoglou, C., & Maltezos, E. (2012). Serotonin receptor 2A -1438G/A promoter polymorphism in relation to obesity and response to sibutramine. Genetic Testing and Molecular Biomarkers, 16(2), 109-112.
Papazoglou D., Restas E., Papanas N., Papatheodorou K., Babouris C., Glaros D., Antonoglou C., et al, Maltezos E.. 2012;Serotonin receptor 2A -1438G/A promoter polymorphism in relation to obesity and response to sibutramine. Genetic Testing and Molecular Biomarkers 16(2):109–112. 10.1089/gtmb.2011.0133.Paxinos, G., & Watson, C. (1986). The Rat Brain in stereotaxic coordinates second edition. San Diego: Academic Press, USA.
Paxinos G., et al, Watson C.. 1986. The Rat Brain in stereotaxic coordinates second edition San Diego: Academic Press, USA.Pjrek, E., Winkler, D., & Kasper, S. (2005). Pharmacotherapy of seasonal affective disorder. CNS Spectrums, 10(8), 664-669.
Pjrek E., Winkler D., et al, Kasper S.. 2005;Pharmacotherapy of seasonal affective disorder. CNS Spectrums 10(8):664–669. 10.1017/s1092852900019623.Renoir, T., Chevarin, C., Lanfumey, L., & Hannan, A. J. (2011). Effect of enhanced voluntary physical exercise on brain levels of monoamines in Huntington disease mice. PLoS Currents, 3:RRN1281.
Renoir T., Chevarin C., Lanfumey L., et al, Hannan A. J.. 2011;Effect of enhanced voluntary physical exercise on brain levels of monoamines in Huntington disease mice. PLoS Currents 3:RRN1281. 10.1371/currents.rrn1281.Sanassi, L. A. (2014). Seasonal affective disorder: Is there light at the end of the tunnel? Official Journal of the American Academy of Physician Assistants, 27(2), 18-22.
Sanassi L. A.. 2014;Seasonal affective disorder: Is there light at the end of the tunnel? Official Journal of the American Academy of Physician Assistants 27(2):18–22.Schramm, N. L., McDonald, M. P., & Limbird, L. E. (2001). The alpha(2a)-adrenergic receptor plays a protective role in mouse behavioral models of depression and anxiety. Journal of Neuroscience, 21(13), 4875-4882.
Schramm N. L., McDonald M. P., et al, Limbird L. E.. 2001;The alpha(2a)-adrenergic receptor plays a protective role in mouse behavioral models of depression and anxiety. Journal of Neuroscience 21(13):4875–4882.Struder, H. K., & Weicker, H. (2001). Physiology and pathophysiology of the serotonergic system and its implications on mental and physical performance. Part Ⅰ. International Journal of Sports Medicine, 22(7), 467-481.
Struder H. K., et al, Weicker H.. 2001;Physiology and pathophysiology of the serotonergic system and its implications on mental and physical performance. Part Ⅰ. International Journal of Sports Medicine 22(7):467–481.Svenningsson, P., Chergui, K., Rachleff, I., Flajolet, M., Zhang, X., El Yacoubi, M., Vaugeois, J. M., Nomikos, G. G., & Greengard, P. (2006). Alterations in 5-HT1B receptor function by p11 in depression-like states. Science, 311(5757), 77-80.
Svenningsson P., Chergui K., Rachleff I., Flajolet M., Zhang X., El Yacoubi M., Vaugeois J. M., Nomikos G. G., et al, Greengard P.. 2006;Alterations in 5-HT1B receptor function by p11 in depression-like states. Science 311(5757):77–80. 10.1126/science.1117571.Takatsu, S., Ishiwata, T., Meeusen, R., Sarre, S., & Hasegawa, H. (2010). Serotonin release in the preoptic area and anterior hypothalamus is not involved in thermoregulation during low-intensity exercise in a warm environment. Neuroscience Letters, 482(1), 7-11.
Takatsu S., Ishiwata T., Meeusen R., Sarre S., et al, Hasegawa H.. 2010;Serotonin release in the preoptic area and anterior hypothalamus is not involved in thermoregulation during low-intensity exercise in a warm environment. Neuroscience Letters 482(1):7–11. 10.1016/j.neulet.2010.06.073.Tuan, T. C., Hsu, T. G., Fong, M. C., Hsu, C. F., Tsai,K. K., Lee, C. Y., & Kong, C. W. (2008). Deleterious effects of short-term, high-intensity exerciseon immune function: evidence from leucocyte mitochondrial alterations and apoptosis. British Journal of Sports Medicine, 42(1), 11-15.
Tuan T. C., Hsu T. G., Fong M. C., Hsu C. F., Tsai K. K., Lee C. Y., et al, Kong C. W.. 2008;Deleterious effects of short-term, high-intensity exerciseon immune function: evidence from leucocyte mitochondrial alterations and apoptosis. British Journal of Sports Medicine 42(1):11–15. 10.1136/bjsm.2006.029314.Ursin, R. (2002). Serotonin and sleep. Sleep Medicine Reviews, 6(1), 55-69.
Ursin R.. 2002;Serotonin and sleep. Sleep Medicine Reviews 6(1):55–69. 10.1053/smrv.2001.0174.Watts, S. W., & Davis, R. P. (2011). 5-hydroxtryptamine receptors in systemic hypertension: an arterial focus. Cardiovascular Therapeutics, 29(1), 54-67.
Watts S. W., et al, Davis R. P.. 2011;5-hydroxtryptamine receptors in systemic hypertension: an arterial focus. Cardiovascular Therapeutics 29(1):54–67. 10.1111/j.1755-5922.2010.00173.x.Watts, S. W., Morrison, S. F., Davis, R. P., & Barman, S. M. (2012). Serotonin and blood pressure regulation. Pharmacological Reviews, 64(2), 359-388.
Watts S. W., Morrison S. F., Davis R. P., et al, Barman S. M.. 2012;Serotonin and blood pressure regulation. Pharmacological Reviews 64(2):359–388. 10.1124/pr.111.004697.Watts, S. W., Priestley, J. R., & Thompson, J. M. (2009). Serotonylation of vascular proteins important to contraction. PloS One, 4(5), e5682.
Watts S. W., Priestley J. R., et al, Thompson J. M.. 2009;Serotonylation of vascular proteins important to contraction. PloS One 4(5):e5682. 10.1371/journal.pone.0005682.Weiss, J. M., Glazer, H. I., Pohorecky, L. A., Brick, J., & Miller, N. E. (1975). Effects of chronic exposure to stressors on avoidance-escape behavior and on brain norepinephrine. Psychosomatic Medicine, 37(6), 522-534.
Weiss J. M., Glazer H. I., Pohorecky L. A., Brick J., et al, Miller N. E.. 1975;Effects of chronic exposure to stressors on avoidance-escape behavior and on brain norepinephrine. Psychosomatic Medicine 37(6):522–534. 10.1097/00006842-197511000-00006.Yuen, A. W., & Jablonski, N. G. (2010). Vitamin D: in the evolution of human skin colour. Medical Hypotheses, 74(1), 39-44.
Yuen A. W., et al, Jablonski N. G.. 2010;Vitamin D: in the evolution of human skin colour. Medical Hypotheses 74(1):39–44. 10.1016/j.mehy.2009.08.007.Zhou, F. C., Sari, Y., Zhang, J. K., Goodlett, C. R., & Li, T. K. (2001). Prenatal alcohol exposure retared the migration and development of serotonin neurons fetal C57Bl mice. Brain Research Developmental Brain Research, 126(2), 147-155.
Zhou F. C., Sari Y., Zhang J. K., Goodlett C. R., et al, Li T. K.. 2001;Prenatal alcohol exposure retared the migration and development of serotonin neurons fetal C57Bl mice. Brain Research Developmental Brain Research 126(2):147–155.