트레드밀 운동이 고지방식이를 섭취한 비만 쥐 골격근의 소포체 스트레스에 미치는 영향
Treadmill Exercise Reduces Endoplasmic Reticulum Stress in High-Fat Diet-Induced Obese Rats Partially by Regulating Unfolded Protein Response
Article information
Abstract
본 연구는 고지방식이로 유도된 비만 흰쥐를 대상으로 지구성 운동이 체중변화, 글루코스 내성 및 소포체 스트레스(ER-stress)에 반응에 관여하는 단백질 발현에 미치는 영향을 규명하는데 목적이 있다. 실험동물은 16주간 고지방식이를 먹인 흰쥐를 사용하였으며 집단은 Sprague-Dawley Control(SD-Con/n=4)집단, High Fat Control(HF-Con/n=4)집단, High Fat exercise(HF-Exe/n=4)으로 구분하고 트레드밀 운동을 하루 30분, 주 5회 총 8주간 21m/min의 속도로 실시하였다. 먼저, 체중과 글루코스 내성은 HF-Con 집단에서 유의하게 가장 높았지만 트레드밀 운동을 실시한 HF-Exe집단에서 유의한 감소를 나타났다. 또한 소포체 스트레스에 반응에 관여하는 glucose-regulated protein 78 (BiP/GRP78), activating transcription factor 6 (ATF6), Pancreatic ER kinase(PERK) 및 inositol-requiring 1α (IRE-1α)/X-box binding protein 1 (XBP-1)은 HF-Con 집단에서 유의하게 증가를 나타냈고, HF-Exe 집단에서 유의한 감소가 나타났다. 따라서 지구성 운동은 고지방 식이로 유도된 비만 휜쥐의 체중 감소와 글루코스 내성을 개선시키고, 소포체 스트레스를 감소시키는데 긍정적인 영향을 미치는 것으로 생각된다.
Trans Abstract
This study was to performed to the effect of 8-week endurance exercise influences on body weight, glucose tolerance and ER-stress in soleus of 16weeks Rats fed High-Fat diet. Rats were randomly assigned to 3 group; (1)Sprague-Dawley Control diet (SD-Con/n=4), (2)High-Fat diet Control (HF-Con/n=4), (3)High-Fat diet Exercise (HF-Exe/n=4). Exercise group ran on the treadmill for 30min/day at the level of 21m/min for 5days/week during 8weeks. Results showed that body weight and glucose tolerance of the HF-Con group was remarkably increased(p<.05) compared to other groups. However, HF-Exe group significantly decreased body weight and glucose tolerance compared to HF-Con group. Moreover, level of GRP78, ATF6, PERK and IER1⍺, which are main proteins of ER-stress were significantly increased in HF-Con group higher than other group, whereas HF-Exe group significantly decreased the expression of GRP78, ATF6, PERK and IER1⍺. Taken together, these finding suggested that the reduction of the body weight, glucose tolerance and unfolded protein response by treadmill exercise may represent a positive adaptation protecting against high-fat diet-induced ER stress.
서 론
한국인을 포함한 아시아인들의 경우 서구인들보다 비만도가 낮음에도 불구하고, 비만, 당뇨병, 고혈압 유병률은 유사한 것으로 나타났다(Oh et al., 2004; Kanazawa et al., 2002). 특히 비만은 다른 대사성 증후군인 당뇨병, 고혈압, 고지혈증 뿐만 아니라 심혈관계질환과 암을 유발하는 심각한 위험 인자로 알려져 있고(Al-Daghri et al., 2002) 이러한 비만을 치료하지 않으면 대사증후군으로 발전할 가능성이 높아지게 되며 인슐린 저항성, 산화적 스트레스, 소포체 스트레스(endoplasmic reticulum stress; ER-stress)와 염증 반응(inflammation response)이 발생하게 된다(Tappy & Le, 2010; Dekker et al., 2010; Mellor et al., 2010).
소포체는 새로운 단백질의 당화(glycosylation) 이황화결합(disufied bond) 등의 과정을 통해 단백질 수정(modification)이나 접힘(folding)을 완성하고 지질이나 콜레스테롤을 합성하며 칼슘 저장소로서의 기능을 수행하지만 생리적 혹은 병리적 조건에 의해 소포체가 처리할 수 있는 능력 이상의 미성숙 단백질이 소포체 내로 유입되거나 소포체내에 돌연변이 단백질 축적 및 칼슘이 고갈되면 소포체 스트레스가 발생한다(Mori, 2000; Oyadomari et al, 2002; Kim et al., 2011).
따라서, 이러한 소포체 스트레스에 대한 반응을 미접힘 단백질 반응(unfolded protein response(UPR))이라고 하며 소포체 기능을 보호하기 위한 세포의 주요 보상기전으로 다양한 내·외적 스트레스로부터 세포를 보호하기 위해 활성화되고 스트레스가 만성적이거나 심하면 손상된 세포를 제거하기 위해 세포사멸 (apoptosis)을 유도한다(Fribley et al., 2009).
UPR은 소포체 막에 존재하는 3가지 신호전달 체계인 pancreatic endoplasmic reticulum kinase(PERK), inositol-requiring 1α(IRE-1α), X-box binding protein 1(XBP-1) 그리고 activating transcription factor 6(ATF6)에 의해 매개된다.
흥미로운 것은 비만일 경우 높은 저밀도지단백과 유리지방산 수준, 전구인슐린 유도체의 분비 이상, 글루코스 독성의 매개체 이상, 미성숙 단백질 발현에 의한 glucose-regulated protein-78(BiP/GRP78)과 ATF mRNA 발현 증가, 이후 XBP 및 C/EBP homologus protein(CHOP) 에 의해 세포사멸을 촉진시키는 소포체 스트레스를 지방조직, 간 및 근조직에서 유발시킨다고 제시하고 있으며(Hotamisligil, 2000; Hendershot, 2004; Gregor et al., 2009; Jiao et al., 2011; Cnop et al., 2012), Ozcan(2004)은 ob/ob 당뇨병 쥐와 장기간 고지방 식이 쥐의 경우, 지방 조직과 간에서 Bip/Grp78, p-PERK, p-eIF2α과 같은 UPR 관련 지표들이 증가하였다고 제시하였다.
특히 고지방 식이 혹은 유전적 요인에 의한 비만은 저산소증과 바이러스 감염 상태에 쉽게 노출되고 무엇보다도 지방조직 및 골격근과 간과 같은 말초조직 내 지방산 저장량이 증가되어 결과적으로 인슐린 저항성, 고혈당, 고인슐린혈증을 초래할 뿐만 아니라 만성적 소포체 스트레스를 일으키고 이에 따라 염증반응이 유발되어 세포사멸을 촉진시킨다(Borg et al., 2012).
규칙적인 신체활동은 비만자 혹은 비만실험모델 동물 모두 포도당 항상성과 인슐린 민감성 향상과 밀접한 관련이 있으며 이러한 효과는 체중 및 체지방 감소를 통한 에너지 대사 조절능력의 개선에 의해 나타나는 것으로 설명되고 있다(Zierath, 2002; Ropelle et al., 2006; Pauli et al., 2008; Irving et al., 2008; Michishita et al., 2008).
최근 비만관련 소포체 스트레스에 대한 연구는 증가하고 있으나 신체활동 혹은 운동이 비만의 원인 중 하나인 소포체 스트레스에 미치는 영향을 직접적으로 규명한 연구는 미흡한 실정이며 특히 선행연구들이 신체활동 혹은 운동이 비만 조건에서 뇌조직과 간 조직 내 소포체 스트레스에 미치는 영향에 대한 연구로 제한되어 있어 골격근 내 소포체 스트레스에 대한 연구는 상당히 부족하다. 따라서 이 연구는 장기간 트레드밀 운동이 16주간 고지방식이로 유도된 흰쥐를 대상으로 지구성 운동을 통해 체중감소와 글루코스 내성의 변화를 살펴보고 골격근 내에서 소포체 스트레스반응에 관여하는 신호전달 체계인 GRP78,PERK, IRE-1α/XBP-1 및 ATF6에 의해 미치는 영향을 규명하는데 목적이 있다.
연구방법
실험동물
실험동물은 22주령 된 Sprague-Dawley(SD)계통의 흰 쥐를 사용하였다. 실험동물 사육은 온도 20±2℃, 습도 50%로 조절 되고, 조명은 주간(09:00-21:00)에 전등 하고, 야간(21:00-09:00)에는 자동적으로 소등하도록 유지하였다. 실험동물은 비만을 유도하기 위해 (주)중앙실험동물(Seoul, Korea)에서 구매한 고지방사료(The original high fat diets, Research Diets, #D12492, 60 kcal% fat)를 집단 간에 몸무게의 차이가 나타나기 시작하는 16주 동안 먹이고 식이량과 수분은 자유 공급하였다. 고지방 식이의 식이 조성은 아래와 같다<표 1>. 비만 유도가 끝난 후 집단은 정상 비교집단(Sprague-Dawley control; SD-con, n=4), 고지방 식이집단(high fat diet control; HF-con, n=4), 고지방 식이+운동집단(high fat diet & exercise; HF-exe, n=4)으로 총 3집단으로 구분하였다.
체중변화 및 내당검사
체중은 실험실용 저울(ML#204, METTLER TOLEDO Co., Columbus, OH, USA)로 주 2회, 총 8주간 측정하였다. 내당검사는 김승석 등(2007)의 방법을 이용하여 검사하였다. 8주간 트레드밀 운동수행 후 동일식이를 준 후에 12시간이 지난 다음 공복 상태에서 쥐 꼬리로부터 혈당을 측정한 뒤, 3차 증류수 1㎖ 글루코스 0.3㎎을 혼합하여 30% 수준의 글루코스 농도로 만든 후 kg당 1㎖ 섭취시킨 후 쥐 꼬리로 부터 총 5회(안정 시, 30분, 60분, 90분, 120분)에 각각 혈액을 채혈하여 혈당 측정기(Gluco-CardⅡ, Daichi Kagaku. Co., Kyoto, Japan)을 이용하여 혈당을 측정하고 총 글루코스 분비반응면적(area under the curve; AUC0-120, mg/dl-1·min-1)은 NCSS 2007 프로그램(NCSS, Utah, USA)으로 분석하였다.
운동프로그램 및 체중측정
HF-exe집단 4마리는 rodent 트레드밀(DJ2-242, Daejong Instrument Industry Co. Seoul, Korea)에서 사전 적응훈련은 하루 10분씩 15m/min 속도로 총 5일간 실시하였다. 본 운동은 주 5일, 8주간 실시하였다. 처음 5분은 8m/min, 다음 5분은 11m/min, 마지막 20분은 21m/min 속도로 실시하였다. 본 연구에서 활용한 운동 프로토콜은 이희혁 등(2009)이 제시한 운동 프로그램을 참고하였다.
골격근 적출
8주간 운동시킨 실험동물을 12시간 절식시킨 후 tiletamin/ zollazepam (ZoletleⓇ., Virbac Labora tories, Carros, France)과 Xylazine(Rumpun, BAYER AG, Germany)을 복강 내에 0.3∼0.4mg 주입해 마취한 다음 양쪽 하퇴에서 가자미근 적출 후 액체질소에 급냉하여 분석 시까지 -80℃의 초저온 냉동기(Bio-Freezer, Forma Science, USA)에 보관하였다.
Western blot
적출된 가자미근 조직은 homogenization buffer와 homogenizer를 이용하여 균질화 하였다. 균질액은 4℃에서 15,000rpm 으로 30분간 원심분리한 후 상층액을 Bradford 방법으로 총 단백질량을 정량하였다. 각 샘플을 Mini-Protein Ⅱ dual-slab apparatus (Bio-Rad Laboratories, Hercules, CA, USA)에 준비된 stacking gel well에 총 단백질량이 30㎍이 되도록 분주하고 80Volt에서 2시간 정도 샘플이 바닥에 닿을 때까지 전기영동 하였다. PVDF membrane(Amersham, Arlington Heights, IL, USA)과 Transfer buffer(190mM glycine, 50mM Tris-Base, 0.05SDS 20% methanol)에 적신 3M paper를 차례로 겹친 다음, Mini trans-blot module(Bio-Rad Laboratories, Hercules, CA, USA)에 장치하고 60Volt로 2시간 전사하였다. 1시간 동안 membrane을 3% BSA 용액으로 blocking시킨 후에 1차 항체인 rabbit polyclonal eIF2α(Cell Signaling Technology, Danvers, MA, USA), goat polyclonal PERK, rabbit polyclonal p-PERK, rabbit polyclonal IRE1α, rabbit polyclonal ATF6, mouse monoclonal ⍺-tubulin(Santa Cruz Biotechnology, Santa Cruz, CA, USA), rabbit polyclonal p-IRE1α, rabbit polyclonal GRP78(Abcam, Cambridge, MA, USA)를 1 : 1000농도로 blocking(3% BSA)용액에 넣어 12시간 동안 반응시켰다. 다음날 TBS-T용액으로 10분씩 4차례 세척을 실시하였다. 그 다음 각각의 1차 항체에 맞는 2차 항체(horseradish peroxidase(HRP)-conjugated goat anti-mouse, Santa Cruz Biotechnology, Santa Cruz, CA, USA; HRP-conjugated rabbit anti-goat, goat anti-rabbit, Invitrogen, Carlsbad, CA, USA)를 blocking 용액으로 1 : 5000으로 희석시켜 90분 동안 흔들어주고 TBS-T 용액으로 10분씩 4차례 세척한 다음, 마지막 단계로 Luminata Forte Western HRP substrate 용액(Millipore Corporation, Billerica, MA, USA)에 membrane을 넣고 1분간 발색하여 얻어진 membrane을 이미지 분석 시스템(Molecular Imager ChemiDoc XRS System, Bio-Rad)을 이용하여 스캔한 다음 Quantity One 1-D Analysis Software (Bio-Rad Laboratories, Hercules, CA, USA)를 통해 단백질량을 산출하였다.
자료처리 방법
이 연구에서 얻어진 자료를 통계분석하기 위해 SPSS 18.0 통계 프로그램을 사용하여 기술통계치인 평균과 표준편차(mean±SD)를 산출하였다. 집단 간 차이 검증을 위해 비모수검정법인 Kruskal-Wallis test를 실시하였으며 집단 간 유의한 차이가 있을 경우 두 그룹씩 Kruskal-Wallis test를 이용하여 사후 검증하였다. 이때 통계적 유의수준은 a=.05로 설정하였다.
연구결과
체중의 변화
고지방 식이로 비만을 유도한 흰쥐를 대상으로 8주간 트레드밀 운동이 집단 간 체중에 미치는 영향을 분석하였다. 먼저 Initial Body Weight(IBW) (x2=7.565, df=2, p=.023), Final Body Weight(FBW) (x2=9.269, df=2, p=.01), Change in Body Weight(CBW) (x2=8.405, df=2, p=.015) 모두 통계적으로 유의한 차이가 있는 것으로 나타났다. 따라서 사후검증을 실시한 결과 IBW는 SD-Con (559.75±3.40) 집단에 비해 HF-Con (681.75±17.40) 집단이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.02), HF-Con 집단과 HF-Exe (675.00±12.29) 집단은 통계적으로 유의한 차이는 없었다. FBW는 SD-Con (573.50±6.35) 집단에 비해 HF-Con (701.50±15.35) 집단이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.021), HF-Con 집단에 비해 HF-Exe (673.37±14.36) 집단은 통계적으로 유의하게 감소한 것으로 나타났다(p=.043). CBW는 SD-Con(13.75±6.40) 집단에 비해 HF-Con (19.75±2.22) 집단이 증가하는 경향은 있었으나 통계적으로 유의한 차이는 없었으며, HF-Con 집단에 비해 HF-Exe (-1.33±2.08) 집단은 통계적으로 유의한 차이가 있었다(p=.021).
글루코스 내성의 변화
고지방 식이로 비만을 유도한 흰쥐를 대상으로 8주간 트레드밀 운동이 집단 간 글루코스 내성의 변화에 미치는 영향을 분석한 결과는 <그림 1>에 제시하였다. 안정시(x2=6.783, df=2, p=.034), 30분(x2=9.846, df=2, p=.007), 60분(x2=9.846, df=2, p=.007), 90분(x2=9.846, df=2, p=.007), 120분(x2=9.846, df=2, p=.007) 모두 차이가 있는 것으로 나타났다. 따라서 사후검증을 실시한 결과, 안정시 SD-Con 집단(94.5±4.04㎎/㎗)에 비해 HF-Con 집단(124.25±5.68㎎/㎗)은 통계적으로 유의하게 증가한 것으로 나타났고(p=.021), HF-Con 집단에 비해 HF-Exe 집단(110.50±14.15㎎/㎗)은 감소한 것으로 나타났지만 통계적으로 유의한 차이는 없었다. 30분에는 SD-Con 집단(146.25±9.06㎎/㎗)에 비해 HF-Con 집단(198.75±11.35㎎/㎗)은 통계적으로 유의하게 증가한 것으로 나타났고(p=.021), HF-Con 집단에 비해 HF-Exe 집단(169.00±9.01㎎/㎗)은 통계적으로 유의하게 감소한 것으로 나타났다(p=.021). 60분에는 SD-Con 집단(155.75±11.09㎎/㎗)에 비해 HF-Con 집단(233.75±18.46㎎/㎗)은 통계적으로 유의하게 증가한 것으로 나타났으며(p=.021), HF-Con 집단에 비해 HF-Exe 집단(184.00±6.22㎎/㎗)은 통계적으로 유의하게 감소한 것으로 나타났다(p=.021). 90분에는 SD-Con 집단(131.75±9.91㎎/㎗)에 비해 HF-Con 집단(214.75±28.88㎎/㎗)은 통계적으로 유의하게 증가한 것으로 나타났으며(p=.021), HF-Con 집단에 비해 HF-Exe 집단(157.25±7.97㎎/㎗)은 통계적으로 유의하게 감소한 것으로 나타났다(p=.021). 마지막으로 120분에는 SD-Con 집단(112.00±9.20㎎/㎗)에 비해 HF-Con 집단(181.75±15.69㎎/㎗)은 통계적으로 유의하게 증가한 것으로 나타났으며(p=.001), HF-Con 집단에 비해 HF-Exe 집단(146.25±9.36㎎/㎗)은 통계적으로 유의하게 감소한 것으로 나타났다(p=.021).
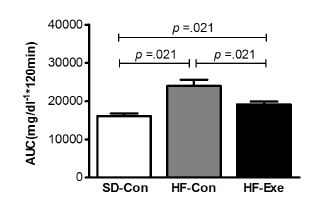
총 글루코스 반응 면적의 차이
고지방 식이로 비만을 유도한 흰쥐를 대상으로 8주간 트레드밀 운동이 집단 간 총 글루코스 반응 면적(AUC)의 차이를 분석한 결과는 <그림 2>와 같다. 집단 간에 통계적으로 유의한 차이(x2=9.846, df=2, p=.021)가 있는 것으로 나타나 사후 검증한 결과 HF-Con집단에 비해 SD-con 집단이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.021), HF-con 집단에 비해 HF-Exe 집단은 통계적으로 유의하게 감소한 것으로 나타났다(p=.021).
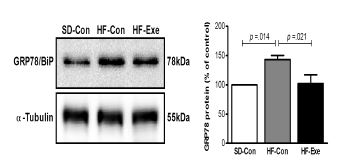
GRP78/BiP 단백질 발현의 변화
고지방 식이로 비만을 유도한 흰쥐를 대상으로 8주간 트레드밀 운동이 집단 간 GRP78/BiP 단백질 발현 변화에 미치는 영향을 분석한 결과는 <그림 3>와 같다. 집단 간에 통계적으로 유의한 차이(x2=8.290, df=2, p=.016)가 있는 것으로 나타나 사후 검증한 결과 HF-Con집단에 비해 SD-con 집단이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.014), HF-con 집단에 비해 HF-Exe 집단은 통계적으로 유의하게 감소한 것으로 나타났다(p=.021).
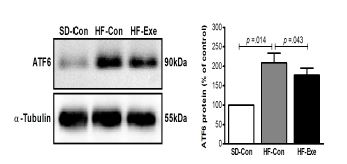
ATF6 단백질 발현의 변화
고지방 식이로 비만을 유도한 흰쥐를 대상으로 8주간 트레드밀 운동이 집단 간 ATF6 단백질 발현 변화에 미치는 영향을 분석한 결과는 <그림 4>과 같다. 집단 간에 통계적으로 유의한 차이(x2=9.605, df=2, p=.008)가 있는 것으로 나타나 사후 검증한 결과 HF-Con집단에 비해 SD-con 집단이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.014), HF-con 집단에 비해 HF-Exe 집단은 통계적으로 유의하게 감소한 것으로 나타났다(p=.043).
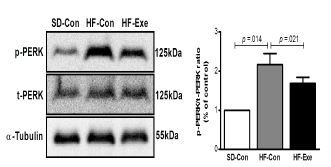
p-PERK/t-PERK 단백질 발현의 변화
고지방 식이로 비만을 유도한 흰쥐를 대상으로 8주간 트레드밀 운동이 집단 간 p-PERK/t-PERK 단백질 발현 변화에 미치는 영향을 분석한 결과는 <그림 5>와 같다. 집단 간에 통계적으로 유의한 차이(x2=10.203, df=2, p=.006)가 있는 것으로 나타나 사후 검증한 결과 HF-Con집단에 비해 SD-con 집단이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.014), HF-con 집단에 비해 HF-Exe 집단은 통계적으로 유의하게 감소한 것으로 나타났다(p=.021).
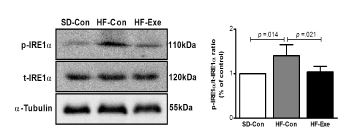
p-IRE1α/t-IRE1α 단백질 발현의 변화
고지방 식이로 비만을 유도한 흰쥐를 대상으로 8주간 트레드밀 운동이 집단 간 p-IRE1α/t-IRE1α 단백질 발현 변화에 미치는 영향을 분석한 결과는 <그림 6>와 같다. 집단 간에 통계적으로 유의한 차이(x2=6.855, df=2, p=.032)가 있는 것으로 나타나 사후 검증한 결과 HF-Con집단에 비해 SD-con 집단이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.014), HF-con 집단에 비해 HF-Exe 집단은 통계적으로 유의하게 감소한 것으로 나타났다(p=.021).
논 의
최근 비만 관련 대사증후군의 발병 기전들 중 하나로 소포체 스트레스가 제시되고 있어 이 연구에서도 비만과 제 2형 당뇨를 예방하거나 지연시키는 대체 방법으로 관심을 받고 있는 트레드밀 운동이 고지방 식이로 유도된 비만 쥐의 골격근 내 소포체 스트레스 반응에 관여하는 분자 샤페론인 BiP/GRP78과 신호전달 단백질인 PERK, IRE-1α, XBP-1 및 ATF6에 미치는 영향을 분석하였다.
먼저 고지방 식이로 비만이 유도된 흰쥐를 대상으로 트레드밀 운동시킨 결과 체중이 현저하게 감소한 것으로 나타났다. 이러한 결과는 8주간 자발적인 운동수행을 통해 지방량 감소와 함께 체중이 현저하게 감소하였다는 Bradley et al.(2008)의 연구, 고지방 식이로 비만을 유도한 흰쥐를 대상으로 지구성 운동을 시킨 결과 지방대사 효율성 증가와 함께 체중이 현저하게 감소하였다고 제시한 Ozacan et al.(2004), 권태동 등(2006), Deldicque et al.(2013)의 연구와 일치하는 것으로 나타났다. 이와 같이 운동을 통해 체중이 감소한 이유는 지방조직에서 지질분해의 증가 및 골격근에서 지방산 이용률의 증가되었기 때문인 것으로 보인다(Ropelle et al., 2006; Pauli et al., 2008).
일반적으로 지구성 운동과 같은 신체활동은 근육에서 포도당 이용률 증가를 통해 내당능장애(glucose intolerance)를 개선시킨다고 알려져 있다(Pan et al., 1997). 이러한 관점에서 고지방 식이를 통해 유발된 비만이 세포내 소포체 스트레스 증가를 통해 내당능장애를 촉진한다면 지구성 운동은 동시에 소포체 스트레스와 포도당 불내성을 감소시킬 것이다. 이 연구에서 활용된 트레드밀 운동 프로토콜은 da Luz et al.(2011)의 결과와 유사하게 고지방 식에 의해 유도된 포도당 불내성을 감소시키는데 효과적인 것으로 나타났다. 또한 인슐린 저항성 지표의 하나인 AUC의 경우에도 트레드밀 운동 집단에서 개선된 것으로 나타났다. 이러한 결과는 Schefer & Talan (1996), Dzamko et al.(2008), Miura et al.(2009)이 12~15m/min의 운동강도는 설치류의 내당능장애를 개선하고 지질 산화를 향상시키는 운동강도라고 제시한 것처럼 이 연구에서 사용한 운동 프로토콜이 인슐린 저항성과 내당능장애를 개선하고 골격근의 지질산화를 향상시키는 적절한 운동 강도로 볼 수 있다. 또한, Gauthier et al.(2003), Vieira et al.(2009)이 제시한 것처럼 트레이닝 기간이 6~8 주, 1일 1시간씩 수행하거나 3주, 1일 3시간씩 지구성 운동을 수행할 때 고지방 식이에 의해 유발된 내당능 장애와 소포체 스트레스가 개선된다고 하는 운동 프로토콜에 관심을 가져야 할 필요가 있는 것으로 생각된다.
이 연구의 목적은 고지방 식이를 통해 비만이 유도된 상태에서 가자미근 내 소포체 스트레스 지표들이 어떻게 반응하는지를 확인하고 트레드밀 운동에 의해 가자미근 내 소포체 스트레스 지표들이 어떻게 반응하는지를 확인하는 것이다. 이를 위해 소포체 내강에 존재하는 분자 샤페론인 BiP/GRP78과 소포체 기능을 보호하기 위한 세포의 주요 보상기전으로 다양한 내· 외적 스트레스로부터 세포를 보호하기 위해 활성화되고 UPR을 매개하는 소포체 막에 존재하는 3가지 신호전달 체계인 PERK, IRE-1α/XBP-1 및 ATF6을 분석하였다.
분석한 결과 고지방 식이에 의해 골격근(가자미근)에서 BiP/GRP78과 UPR 관련 변인들의 발현이 높게 발현한 것으로 나타났다. 이러한 결과는 Hotamisligil(2010), Calfon et al.(2002), Ozacan et al.(2004), Gregor et al.(2009), Jiao et al.(2011), Cnop et al.(2012), Deldicque et al.(2013)의 결과와 일치한다. 이처럼 고지방 식이에 의한 근육 내 BiP/GRP78의 증가는 글루코스 고갈, 높은 저밀도지단백과 유리지방산 수준, 저산소증, pH 저하, 소포체의 Ca2+감소 및 미성숙 단백질 침적에 의해 증가하는 것으로 보고되고 있다(Verkhratsky & Toescu, 2003; Kawasaki et al., 2012).
또한 이 연구에서는 고지방 식이가 분자 샤폐론인 Bip/GRP78과 UPR 관련 변인들을 증가시킨다는 것을 확인한 후 장기간 트레드밀 운동이 분자 샤폐론인 Bip/GRP78과 UPR 관련 변인들을 감소 시키는지를 검증한 결과 가자미근 내에서 Bip/GRP78과 PERK, IRE-1α/XBP-1 및 ATF6이 현저하게 감소하였는데 이러한 결과는 트레드밀 운동을 수행한 비만과 당뇨유발 쥐의 골격근(가자미근), 간과 지방조직내 Bip/GRP78과 UPR 관련 변인(PERK, IRE-1α, ATF6, eIF2α)들의 발현량이 감소하였다는 김양희 & 윤진환, (2005), da Luz(2011)의 연구와는 일치하나 고지방식이 쥐를 대상으로 트레드밀 운동을 시킨 결과 Bip/Grp78과 UPR 관련 변인들의 발현량이 증가하였다는 Chapados & Lavoie, (2010)의 결과와는 상반된 경향을 나타내었다. 또한 근조직은 아니나 뇌에서 장기간 고지방 식이에 유도된 비만 쥐를 대상으로 자발적 운동을 시킨 결과 세포사멸 신호전달의 활성 없이 UPR이 증가시켰다는 결과도 주목 할 만하다(Kim et al., 2010).
이와 같이 연구들 간에 상반된 결과를 보이는 것은 고지방 식이구성 및 섭취기간과 운동방법(기간, 강도, 빈도)에 기인한 것으로 보이나 많은 선행연구들이 트레드밀 운동을 통해 고혈당, 고인슐린혈증, 저밀도지단백과 유리지방산 수준의 감소와 소포체내 미성숙 단백질 및 돌연변이 단백질 침적의 감소를 통해 BiP/GRP78과 UPR 관련 변인들의 발현량이 감소하였다고 설명하고 있으며 지구성 운동은 골격근의 생리적 ER 스트레스 적응을 유도하거나 다른 스트레스로 부터 골격근을 보호하고 지방산 산화를 촉진하여 고지방 식이의 해로운 효과 감소시킨다고 제시되고 있다(김양희 & 윤진환, 2005; Kim, 2011; da Luz et al., 2011; Wu et al., 2011). 전체적으로 16주간의 장기간 고지방 식이는 소포체 스트레스를 유발하고 반면 트레드밀 운동은 장기간 고지방 식이에 노출된 비만 쥐의 골격근(가자미근)내 소포체 스트레스를 감소시키는 것으로 나타났다. 이 연구는 집단 간 사례수가 4마리로 연구결과를 일반화하기에는 다소 무리가 있지만 고지방 식이로 유도된 비만으로 인한 소포체 스트레스와 트레드밀 운동의 관련성을 밝히는 기초자료를 제공하는데 의의가 있다.
결 론
이 연구는 16주간 고지방식이로 유도한 흰쥐를 대상으로 8주간의 지구성 운동이 골격근 내 소포체 스트레스 반응에 관여하는 분자 샤페론인 BiP/GRP78과 UPR 신호전달 단백질인 PERK, IRE-1α/XBP-1 및 ATF6에 의해 미치는 영향을 분석한 결과, 트레드밀 운동에 의해 체중과 포도당 불내성이 개선되고 분자 샤페론인 BiP/GRP78수준은 감소되었으며 골격근 내 소포체 스트레스 반응에 관여하는 3가지 신호전달 체계인 PERK, IRE-1α/XBP-1 및 ATF6 수준이 감소되었다.
따라서 지구성 운동은 고지방식이로 유도된 비만 흰쥐에서 세포 내 항상성 유지를 위해 소포체 스트레스를 감소시킨 것으로 나타났다. 결론적으로 지구성 운동은 체중과 포도당 불내성을 개선시키고 고지방 식이에 노출된 비만 쥐의 골격근(가자미근)내 소포체 스트레스를 감소시키는 것으로 나타났다. 즉 비만 혹은 제 2형 당뇨 조건에서 지구성 운동에 의한 소포체 스트레스 반응의 감소는 다른 세포 스트레스에 대처하는 긍정적인 보호 효과 있음을 의미한다.
Acknowledgements
이 논문은 2014년 한국체육대학교 홍석민의 석사학위논문을 요약·정리하였음.
References
김승석, 강은범, 김범수, 임예현, 엄현섭, 김철현, 박준영, 정명희, 정국현, 조인호, 이선장, 조준용(2007). 지구성 운동이 Goto-Kakizaki 쥐 골격근 형태별 GLUT-4, LDH, MCT-1과 COX-IV 발현에 미치는 영향. 운동영양학회지, 11(2), 97-107.
김 승석, 강 은범, 김 범수, 임 예현, 엄 현섭, 김 철현, 박 준영, 정 명희, 정 국현, 조 인호, 이 선장, 조 준용. 2007;지구성 운동이 Goto-Kakizaki 쥐 골격근 형태별 GLUT-4, LDH, MCT-1과 COX-IV 발현에 미치는 영향. 운동영양학회지 11(2):97–107.권태동, 손태현, 김기훈, 류승필, 허만동, 여윤기, 정난희(2006). 고지방식이 섭취 흰쥐에서 운동부하가 골격근의 지방대사율 및 AMPK 발현에 미치는 영향. 운동영양학회지, 10(3), 323-329.
권 태동, 손 태현, 김 기훈, 류 승필, 허 만동, 여 윤기, 정 난희. 2006;고지방식이 섭취 흰쥐에서 운동부하가 골격근의 지방대사율 및 AMPK 발현에 미치는 영향. 운동영양학회지 10(3):323–329.김양희, 윤진환(2005). 운동강도의 차이가 streptozotocin -유도 당뇨쥐의 가자미근 GRP-78과 GLUT-4 발현에 미치는 영향. Journal of Life Science, 15(1), 87-93.
김 양희, 윤 진환. 2005;운동강도의 차이가 streptozotocin -유도 당뇨쥐의 가자미근 GRP-78과 GLUT-4 발현에 미치는 영향. Journal of Life Science 15(1):87–93.이희혁, 윤진환, 정일규, 김승희, 김보균, 등(2009). 운동강도가 ICV STZ 투여로 유발된 기억력 손상흰쥐에서 해마 신경세포생성과 BDNF 발현에 미치는 영향. 운동과학, 18(4), 475-488.
이 희혁, 윤 진환, 정 일규, 김 승희, 김 보균, 등. 2009;운동강도가 ICV STZ 투여로 유발된 기억력 손상흰쥐에서 해마 신경세포생성과 BDNF 발현에 미치는 영향. 운동과학 18(4):475–488.Al-Daghri, N., Bartlett, W. A., Jones, A. F., & Kumar, S. (2002). Role of leptin in glucose metabolism in type 2 diabetes. Diabetes, obesity & metabolism, 4(3), 147-155.
Al-Daghri N., Bartlett W. A., Jones A. F., et al, Kumar S.. 2002;Role of leptin in glucose metabolism in type 2 diabetes. Diabetes, obesity & metabolism 4(3):147–155. 10.1046/j.1463-1326.2002.00194.x.Borg, M. L., Omran, S. F., Weir, J., Meikle, P. J., & Watt, M. J. (2012). Consumption of a high-fat diet, but not regular endurance exercise training, regulates hypothalamic lipid accumulation in mice. The Journal of physiology, 1(590), 4377-4389.
Borg M. L., Omran S. F., Weir J., Meikle P. J., et al, Watt M. J.. 2012;Consumption of a high-fat diet, but not regular endurance exercise training, regulates hypothalamic lipid accumulation in mice. The Journal of physiology 1(590):4377–4389.Bradley, R. L., Jeon, J. Y., Liu, F. F., & Maratos-Flier, E. (2008). Voluntary exercise improves insulin sensitivity and adipose tissue inflammation in diet-induced obese mice. American journal of physiology. Endocrinology and metabolism, 295(3), 586-594.
Bradley R. L., Jeon J. Y., Liu F. F., et al, Maratos-Flier E.. 2008;Voluntary exercise improves insulin sensitivity and adipose tissue inflammation in diet-induced obese mice. American journal of physiology. Endocrinology and metabolism 295(3):586–594. 10.1152/ajpendo.00309.2007.Calfon, M., Zeng, H., Urano, F., Till, J. H., Hubbard, S. R., Harding, H. P., Clark, S. G., & Ron, D. (2002). IRE1 couples endoplasmic reticulum load to secretory capacity by processing the XBP-1 mRNA. Nature, 415(6867), 92-96.
Calfon M., Zeng H., Urano F., Till J. H., Hubbard S. R., Harding H. P., Clark S. G., et al, Ron D.. 2002;IRE1 couples endoplasmic reticulum load to secretory capacity by processing the XBP-1 mRNA. Nature 415(6867):92–96.Chapados, N. A., & Lavoie, J. M. (2010). Exercise training increases hepatic endoplasmic reticulum (er) stress protein expression in MTP-inhibited high-fat fed rats. Cell biochemistry and function, 28(3), 202-210.
Chapados N. A., et al, Lavoie J. M.. 2010;Exercise training increases hepatic endoplasmic reticulum (er) stress protein expression in MTP-inhibited high-fat fed rats. Cell biochemistry and function 28(3):202–210. 10.1002/cbf.1643.Cnop, M., Foufelle, F. & Velloso, L. A. (2012). Endoplasmic reticulum stress obesity and diabetes. Trends in molecular medicine, 18(1), 59-68.
Cnop M., Foufelle F., et al, Velloso L. A.. 2012;Endoplasmic reticulum stress obesity and diabetes. Trends in molecular medicine 18(1):59–68.Da Luz, G., Frederico, M. J., da Silva, S., Vitto, M. F., Cesconetto, P. A., de Pinho, R. A., Pauli, J. R., Silva, A. S., Cintra, D. E., Ropelle, E. R., & De Souza, C. T. (2011). Endurance exercise training ameliorates insulin resistance and reticulum stress in adipose and hepatic tissue in obese rats. European Journal of Applied Physiology, 111(9), 2015-2023.
Da Luz G., Frederico M. J., da Silva S., Vitto M. F., Cesconetto P. A., de Pinho R. A., Pauli J. R., Silva A. S., Cintra D. E., Ropelle E. R., et al, Souza C. T.. 2011;Endurance exercise training ameliorates insulin resistance and reticulum stress in adipose and hepatic tissue in obese rats. European Journal of Applied Physiology 111(9):2015–2023. 10.1007/s00421-010-1802-2.Dekker, M. J., Su, Q., Baker, C., Rutledge, A. C., & Adeli, K. (2010). Fructose: a highly lipogenic nutrient implicated in insulin resistance, hepatic steatosis, and the metabolic syndrome. American journal of physiology. Endocrinology and metabolism, 299(5), 685-694.
Dekker M. J., Su Q., Baker C., Rutledge A. C., et al, Adeli K.. 2010;Fructose: a highly lipogenic nutrient implicated in insulin resistance, hepatic steatosis, and the metabolic syndrome. American journal of physiology. Endocrinology and metabolism 299(5):685–694.Deldicque, L., Cani, P. D., Delzenne, N. M., Baar, K., & Francaux, M. (2013). Endurance training in mice increases the unfolded protein response induced by a high-fat diet. Journal of physiology and biochemistry. 69(2), 215-225.
Deldicque L., Cani P. D., Delzenne N. M., Baar K., et al, Francaux M.. 2013;Endurance training in mice increases the unfolded protein response induced by a high-fat diet. Journal of physiology and biochemistry 69(2):215–225. 10.1007/s13105-012-0204-9.Dzamko, N., Schertzer, J. D., Ryall, J. G., Steel, R., Macaulay, S. L., Wee, S., Chen, Z. P., Michell, B. J., Oakhill, J. S., Watt, M. J., Jørgensen, S. B., Lynch, G. S., Kemp, B. E., & Steinberg, G. R. (2008). AMPK-independent pathways regulate skeletal muscle fatty acid oxidation. The Journal of physiology, 1(586), 5819-5831.
Dzamko N., Schertzer J. D., Ryall J. G., Steel R., Macaulay S. L., Wee S., Chen Z. P., Michell B. J., Oakhill J. S., Watt M. J., Jørgensen S. B., Lynch G. S., Kemp B. E., et al, Steinberg G. R.. 2008;AMPK-independent pathways regulate skeletal muscle fatty acid oxidation. The Journal of physiology 1(586):5819–5831.Fribley, A., Zhang K., & Kaufman, R. J. (2009). Regulation of apoptosis by the unfolded protein response. Methods in molecular biology, 559, 191-204.
Fribley A., K. Zhang, et al, Kaufman R. J.. 2009;Regulation of apoptosis by the unfolded protein response. Methods in molecular biology 559:191–204.Gauthier, M. S., Couturier, K., Latour, J. G., & Lavoie, J. M. (2003). Concurrent exercise prevents high-fat-diet-induced macrovesicular hepatic steatosis. Journal of applied physiology, 94(6), 2127-2734.
Gauthier M. S., Couturier K., Latour J. G., et al, Lavoie J. M.. 2003;Concurrent exercise prevents high-fat-diet-induced macrovesicular hepatic steatosis. Journal of applied physiology 94(6):2127–2734. 10.1152/japplphysiol.01164.2002.Graf, C., Ferrari, N., & Eiser, S. (2013). Obesity--status quo and therapeutic approaches. MMW Fortschritte der Medizin, 1(1), 91-94.
Graf C., Ferrari N., et al, Eiser S.. 2013;Obesity--status quo and therapeutic approaches. MMW Fortschritte der Medizin 1(1):91–94.Gregor, M. F., Yang, L., Fabbrini, E., Mohammed, B. S., Eagon, J. C., Hotamisligil, G. S., & Klein, S. (2009). Endoplasmic reticulum stress is reduced in tissues of obese subjects after weight loss. Diabetes, 58(3), 693-700.
Gregor M. F., Yang L., Fabbrini E., Mohammed B. S., Eagon J. C., Hotamisligil G. S., et al, Klein S.. 2009;Endoplasmic reticulum stress is reduced in tissues of obese subjects after weight loss. Diabetes 58(3):693–700. 10.2337/db08-1220.Hendershot, L. M. (2004). The ER function BiP is a master regulator of ER function. The Mount Sinai journal of medicine, New York, 71(5), 289-297.
Hendershot L. M.. 2004;The ER function BiP is a master regulator of ER function. The Mount Sinai journal of medicine, New York 71(5):289–297.Hotamisligil, G. S. (2010). Molecular mechanisms of insulin resistance and the role of the adipocyte. Int J Obes Relat Metab Disord. 24 Suppl 4, S23-7.
Hotamisligil G. S.. 2010;Molecular mechanisms of insulin resistance and the role of the adipocyte. Int J Obes Relat Metab Disord 24et al. :S23–7.Irving, B. A., Davis, C. K., Brock, D. W., Weltman, J. Y., Swift, D., Barrett, E. J., Gaesser, G. A., & Weltman, A. (2008). Effect of exercise training intensity on abdominal visceral fat and body composition. Med Sci Sports Exerc. 40(11):1863-1872.
Irving B. A., Davis C. K., Brock D. W., Weltman J. Y., Swift D., Barrett E. J., Gaesser G. A., et al, Weltman A.. 2008;Effect of exercise training intensity on abdominal visceral fat and body composition. Med Sci Sports Exerc 40(11):1863–1872. 10.1249/mss.0b013e3181801d40.Jiao, P., Ma, J., Feng, B., Zhang, H., Diehl, J. A., Chin, Y. E., Yan, W., & Xu, H. (2011). FFA-induced adipocyte inflammation and insulin resistance: involvement of ER stress and IKKβ pathways. Obesity, 19, 483-491.
Jiao P., Ma J., Feng B., Zhang H., Diehl J. A., Chin Y. E., Yan W., et al, Xu H.. 2011;FFA-induced adipocyte inflammation and insulin resistance: involvement of ER stress and IKKβ pathways. Obesity 19:483–491. 10.1038/oby.2010.200.Kanazawa, M., Yoshiike, N., Osaka, T., Numba, Y., Zimmet, P., & Inoue, S. (2002). Criteria and classification of obesity in Japan and Asia-Oceania. Asia Pac J Clin Nutr, 8, S732-737.
Kanazawa M., Yoshiike N., Osaka T., Numba Y., Zimmet P., et al, Inoue S.. 2002;Criteria and classification of obesity in Japan and Asia-Oceania. Asia Pac J Clin Nutr 8:S732–737.Kawasaki, N., Asada, R., Saito, A., Kanemoto, S., & Imaizumi, K. (2012). Obesity-induced endoplasmic reticulum stress causes chronic inflammation in adipose tissue. Sci Rep, 2, 799. doi: 10.1038/srep00799
. Kawasaki N., Asada R., Saito A., Kanemoto S., et al, Imaizumi K.. 2012;Obesity-induced endoplasmic reticulum stress causes chronic inflammation in adipose tissue. Sci Rep 2:799. 10.1038/srep00799.Kim, Y., Park, M., Boghossian, S., York, D. A. (2010). Three weeks voluntary running wheel exercise increases endoplasmic reticulum stress in the brain of mice. Brain research, 4(1317), 13-23.
Kim Y., Park M., Boghossian S., York D. A.. 2010;Three weeks voluntary running wheel exercise increases endoplasmic reticulum stress in the brain of mice. Brain research 4(1317):13–23.Kim, H. Y., Kim, B. R., Kim, Y., Kim, G. D., & Kim, H. J. (2011). The effect of cisplatin on endoplasmic reticulum stress of human cervical cancer cells. Korean Journal of Obstetric Gynecology, 54(4), 175-183.
Kim H. Y., Kim B. R., Kim Y., Kim G. D., et al, Kim H. J.. 2011;The effect of cisplatin on endoplasmic reticulum stress of human cervical cancer cells. Korean Journal of Obstetric Gynecology 54(4):175–183. 10.5468/kjog.2011.54.4.175.Mellor, K. M., Ritchie, R. H., & Delbridge, L. M. (2010). Reactive oxygen species and insulin-resistant cardiomyopathy. Clin Exp Pharmacol Physiol, 37(2), 222-228.
Mellor K. M., Ritchie R. H., et al, Delbridge L. M.. 2010;Reactive oxygen species and insulin-resistant cardiomyopathy. Clin Exp Pharmacol Physiol 37(2):222–228. 10.1111/j.1440-1681.2009.05274.x.Michishita, R., Shono, N., Kasahara, T., & Tsuruta, T. (2008). Effects of low intensity exercise therapy on early phase insulin secretion in overweight subjects with impaired glucose tolerance and type 2 diabetes mellitus. Diabetes Res Clin Pract, 82(3), 291-297.
Michishita R., Shono N., Kasahara T., et al, Tsuruta T.. 2008;Effects of low intensity exercise therapy on early phase insulin secretion in overweight subjects with impaired glucose tolerance and type 2 diabetes mellitus. Diabetes Res Clin Pract 82(3):291–297. 10.1016/j.diabres.2008.08.013.Miura, S., Kai, Y., Kamei, Y., Bruce, C. R., Kubota, N., Febbraio, M. A., Kadowaki, T., & Ezaki, O. (2009). Alpha2-AMPK activity is not essential for an increase in fatty acid oxidation during low-intensity exercise. Am J Physiol Endocrinol Metab. 296(1), E47-55.
Miura S., Kai Y., Kamei Y., Bruce C. R., Kubota N., Febbraio M. A., Kadowaki T., et al, Ezaki O.. 2009;Alpha2-AMPK activity is not essential for an increase in fatty acid oxidation during low-intensity exercise. Am J Physiol Endocrinol Metab 296(1):E47–55.Moredich, C. A., & Kessler, T. A. (2013). Physical Activity and Nutritional Weight Loss Interventions in Obese, Low-Income Women: An Integrative Review. J Midwifery Womens Health. 2013 Nov 20.
Moredich C. A., et al, Kessler T. A.. 2013;Physical Activity and Nutritional Weight Loss Interventions in Obese, Low-Income Women: An Integrative Review. J Midwifery Womens Health 2013;Nov. 20.Mori, K. (2000). Tripartite management of unfolded proteins in the endoplasmic reticulum. Cell, 101(5), 451-454.
Mori K.. 2000;Tripartite management of unfolded proteins in the endoplasmic reticulum. Cell 101(5):451–454. 10.1016/s0092-8674(00)80855-7.Oh, S. W., Shin, S. A., Yun, Y. H., Yoo, T., & Huh, B. Y. (2004). Cut-off point of BMI and obesity-related comorbidities and mortality in middle-aged Koreans. Obes Res, 12(12), 2031-2040.
Oh S. W., Shin S. A., Yun Y. H., Yoo T., et al, Huh B. Y.. 2004;Cut-off point of BMI and obesity-related comorbidities and mortality in middle-aged Koreans. Obes Res 12(12):2031–2040. 10.1038/oby.2004.254.Oyadomari, S., Araki, E., & Mori, M. (2002). Endoplasmic reticulum stress-mediated apoptosis in pancreatic beta-cells. Apoptosis, 7(4), 335-345.
Oyadomari S., Araki E., et al, Mori M.. 2002;Endoplasmic reticulum stress-mediated apoptosis in pancreatic beta-cells. Apoptosis 7(4):335–345.Ozcan, U. (2004). Endoplasmic reticulum stress links obesity insulin action and type 2 diabetes. Science, 306, 457–461.
Ozcan U.. 2004;Endoplasmic reticulum stress links obesity insulin action and type 2 diabetes. Science 306:457–461. 10.1126/science.1103160.Pan, X. R., Li, G. W., Hu, Y. H., Wang, J. X., Yang, W. Y., An, Z. X., Hu, Z. X., Lin, J., Xiao, J. Z., Cao, H. B., Liu, P. A., Jiang, X. G., Jiang, Y. Y., Wang, J. P., Zheng, H., Zhang, H., Bennett, P. H., & Howard, B. V. (1997). Effects of diet and exercise in preventing NIDDM in people with impaired glucose tolerance. The Da Qing IGT and Diabetes Study. Diabetes Care, 20(4), 537-544.
Pan X. R., Li G. W., Hu Y. H., Wang J. X., Yang W. Y., An Z. X., Hu Z. X., Lin J., Xiao J. Z., Cao H. B., Liu P. A., Jiang X. G., Jiang Y. Y., Wang J. P., Zheng H., Zhang H., Bennett P. H., et al, Howard B. V.. 1997;Effects of diet and exercise in preventing NIDDM in people with impaired glucose tolerance. The Da Qing IGT and. Diabetes Study. Diabetes Care 20(4):537–544.Pauli, J. R., Ropelle, E. R., Cintra, D. E., Carvalho-Filho, M. A., Moraes, J. C., De Souza, C. T., Velloso, L. A., Carvalheira, J. B., Saad, M. J. (2008). Acute physical exercise reverses S-nitrosation of the insulin receptor, insulin receptor substrate 1 and protein kinase B/Akt in diet-induced obese Wistar rats. J Physiol. 586(2), 659-671.
Pauli J. R., Ropelle E. R., Cintra D. E., Carvalho-Filho M. A., Moraes J. C., De Souza C. T., Velloso L. A., Carvalheira J. B., Saad M. J.. 2008;Acute physical exercise reverses S-nitrosation of the insulin receptor, insulin receptor substrate 1 and protein kinase B/Akt in diet-induced obese Wistar rats. J Physiol 586(2):659–671. 10.1113/jphysiol.2007.142414.Ropelle, E. R., Pauli, J. R., Prada, P. O., de Souza, C. T., Picardi, P. K., Faria, M. C., Cintra, D. E., Fernandes, M. F., Flores, M. B., Velloso, L. A., Saad, M. J., Carvalheira, J. B. (2006). Reversal of diet-induced insulin resistance with a single bout of exercise in the rat: the role of PTP1B and IRS-1 serine phosphorylation. J Physiol, 15(577), 997-1007.
Ropelle E. R., Pauli J. R., Prada P. O., de Souza C. T., Picardi P. K., Faria M. C., Cintra D. E., Fernandes M. F., Flores M. B., Velloso L. A., Saad M. J., Carvalheira J. B.. 2006;Reversal of diet-induced insulin resistance with a single bout of exercise in the rat: the role of PTP1B and IRS-1 serine phosphorylation. J Physiol 15(577):997–1007.Schefer, V., & Talan, M. I. (1996). Oxygen consumption in adult and AGED C57BL/6J mice during acute treadmill exercise of different intensity. Exp Gerontol, 31(3), 387-392.
Schefer V., et al, Talan M. I.. 1996;Oxygen consumption in adult and AGED C57BL/6J mice during acute treadmill exercise of different intensity. Exp Gerontol 31(3):387–392. 10.1016/0531-5565(95)02032-2.Tappy, L., & Le, K.A. (2010). Metabolic effects of fructose and the worldwide increase in obesity. Physiol Rev, 90(1), 23-46.
Tappy L., et al, Le K.A.. 2010;Metabolic effects of fructose and the worldwide increase in obesity. Physiol Rev 90(1):23–46. 10.1152/physrev.00019.2009.Verkhratsky, A., & Toescu, E. C. (2003). Endoplasmic reticulum Ca(2+) homeostasis and neuronal death. J Cell Mol Med, 7(4), 351-361.
Verkhratsky A., et al, Toescu E. C.. 2003;Endoplasmic reticulum Ca(2+) homeostasis and neuronal death. J Cell Mol Med 7(4):351–361. 10.1111/j.1582-4934.2003.tb00238.x.Vieira, V. J., Valentine, R. J., Wilund, K. R., & Woods, J. A. (2009). Effects of diet and exercise on metabolic disturbances in high-fat diet-fed mice. Cytokine. 46(3), 339-345.
Vieira V. J., Valentine R. J., Wilund K. R., et al, Woods J. A.. 2009;Effects of diet and exercise on metabolic disturbances in high-fat diet-fed mice. Cytokine 46(3):339–345. 10.1016/j.cyto.2009.03.006.Wu, J., Ruas, J. L., Estall, J. L., Rasbach, K. A., Choi, J. H., Ye, L., Boström, P., Tyra, H. M., Crawford, R. W., Campbell, K. P., Rutkowski, D. T., Kaufman, R. J., Spiegelman, B. M. (2011). The unfolded protein response mediates adaptation to exercise in skeletal muscle through a PGC-1α/ATF6α complex. Cell Metab, 13(2), 160-169.
Wu J., Ruas J. L., Estall J. L., Rasbach K. A., Choi J. H., Ye L., Boström P., Tyra H. M., Crawford R. W., Campbell K. P., Rutkowski D. T., Kaufman R. J., Spiegelman B. M.. 2011;The unfolded protein response mediates adaptation to exercise in skeletal muscle through a PGC-1α/ATF6α complex. Cell Metab 13(2):160–169. 10.1016/j.cmet.2011.01.003.Zierath, J. R. (2002). Exercise training-induced changes in insulin signaling in skeletal muscle. J Appl Physiol, 93(2), 773-781.
Zierath J. R.. 2002;Exercise training-induced changes in insulin signaling in skeletal muscle. J Appl Physiol 93(2):773–781.