유산소운동강도가 30대 경계성 고혈압 남성의 운동 후 혈압과 심혈관기능에 미치는 영향
Effects of Aerobic Exercise Intensity on Post-exercise Blood Pressure and Cardiovascular Function in Prehypertensive Men in Their 30s
Article information
Abstract
[목적]
운동 후 저혈압(post-exercise hypotension: PEH)은 일회성 운동 후 회복기 중에 혈압이 안정 시 수준보다 더 낮은 상태로 장시간 지속되는 현상으로서, 고혈압자의 경우 장기간의 운동 트레이닝 중 PEH가 누적되면서 혈압이 감소된다. 이 연구에서는 두 가지의 유산소운동강도가 운동 후 혈압과 심혈관기능에 미치는 영향을 규명하고자 하였다.
[방법]
30대 경계성 고혈압 남성 11명이 두 가지 처치에 1주일의 wash-out을 두고 counter-balanced order에 따라 반복 참여하였다. 첫 번째 처치는 VO2max의 70% 강도로 일정하게 실시하는 중강도 지속적 운동(moderate-intensity continuous exercise: MICE)이었고, 두 번째 처치는 VO2max의 50%와 90%를 번갈아가며 실시하는 고강도 인터벌 운동(high-intensity interval exercise: HIIE)이었다. 각 처치마다 30분간의 운동 후 1시간 동안 혈압과 심혈관기능 변인을 측정하였다.
[결과]
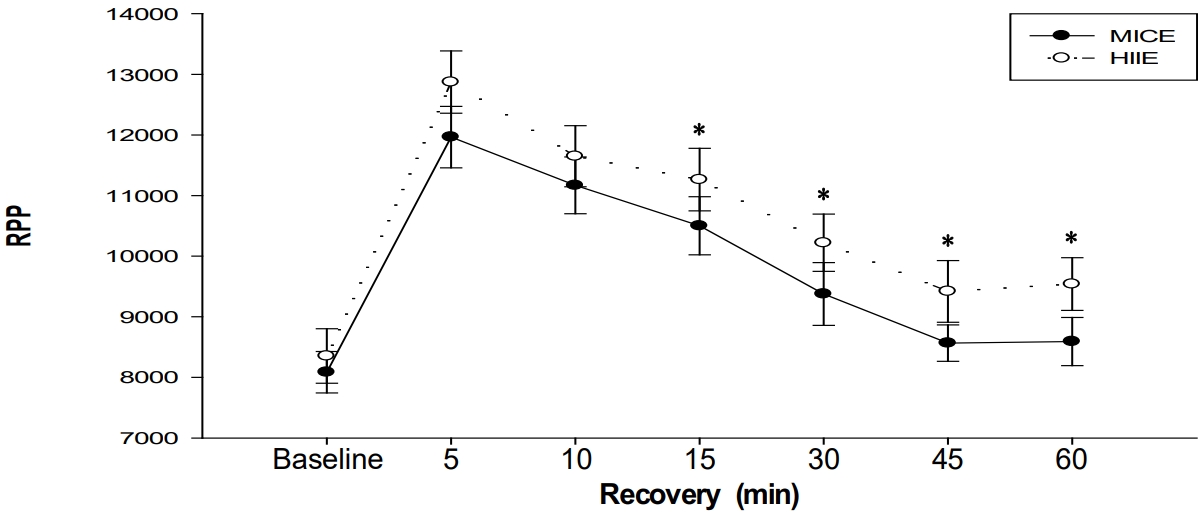
1) Systolic blood pressure는 HIIE 처치에서 안정시와 비교하여 운동 후 회복기 30분과 45분 시점에서 유의하게 낮았으며, HIIE 처치가 MICE 처치보다 운동 후 회복기 10분, 15분, 그리고 30분 시점에서 유의하게 낮았다. 2) Rate pressure product는 HIIE 처치가 MICE 처치보다 운동 후 회복기 15분, 30분, 45분, 그리고 60분 시점에서 유의하게 높았다. 3) Heart rate는 HIIE 처치가 MICE 처치보다 운동 후 회복기 15분, 30분, 45분, 그리고 60분 시점에서 유의하게 높았다. 4) Stroke volume은 HIIE 처치가 MICE 처치보다 운동 후 회복기 30분 시점에서 유의하게 낮았다. 5) Cardiac output은 HIIE 처치가 MICE 처치보다 운동 후 회복기 15분 시점에서 유의하게 높았다. 6) Total vascular conductance는 HIIE 처치가 MICE 처치보다 운동 후 회복기 15분과 30분 시점에서 유의하게 높았다. 7) Total peripheral resistance는 HIIE 처치가 MICE 처치보다 운동 후 회복기 15분과 30분 시점에서 유의하게 낮았다.
[결론]
이상의 연구 결과를 종합하면, HIIE 처치가 MICE 처치보다 회복기 중 심혈관 스트레스가 높았지만, PEH 반응의 증대와 심혈관기능의 개선에 더 효과적이었다고 결론지을 수 있다. 따라서 30대 경계성 고혈압 남성의 혈압 조절과 심혈관기능 개선에 MICE보다 HIIE를 보다 적극적으로 적용할 필요가 있다고 판단된다. 향후 경계성 고혈압 남성을 대상으로 HIIE 트레이닝과 MICE 트레이닝의 혈압 강하 효과를 종단적으로 비교하는 후속 연구가 요청된다.
Trans Abstract
PURPOSE
Blood pressure (BP) in hypertensive individuals is reduced by the accumulation of post-exercise hypotension (PEH) induced by a long period of training. This study aimed to investigate the effects of intensity of two different aerobic exercises with identical energy expenditure on post-exercise blood pressure and cardiovascular function in prehypertensive men.
METHODS
Eleven prehypertensive men in their 30s participated in two trials repeatedly. In the first trial, the exercise was moderate in intensity and continuous (MICE) with 70% of VO2max, and the exercise in the second trial was high-intensity interval exercise (HIIE) with 50% and 90% of VO2max. Each exercise was performed for 30 min, and the variables related to BP and cardiovascular function were measured at certain times for 1 hr during the recovery phase.
RESULTS
Our main findings are as follows: (1) Systolic blood pressure was significantly lower at 30 and 45 min of recovery time than the baseline in the HIIE trial, and systolic blood pressure was significantly lower in the HIIE trial than the MICE trial at 10, 15, and 30 min of recovery time. (2) The rate pressure product was significantly higher in the HIIE trial than the MICE trial at 15, 30, 45, and 60 min of recovery time. (3) The heart rate was significantly higher in the HIIE trial than the MICE trial at 15, 30, 45, and 60 min of recovery time. (4) Stroke volume was significantly lower in the HIIE trial than the MICE trial at 30 min of recovery time. (5) Cardiac output was significantly higher in the HIIE trial than the MICE trial at 15 min of recovery phase. (6) Total vascular conductance was significantly higher in the HIIE trial than the MICE trial at 15 and 30 min of recovery phase. (7) Total peripheral resistance was significantly lower in the HIIE trial than the MICE trial at 15 and 30 min of recovery phase.
CONCLUSIONS
The HIIE shows a higher cardiovascular stress than MICE; however, HIIE contributes to the augmentation of PEH and improvement of cardiovascular function. Therefore, HIIE rather than MICE should be suggested in BP control and enhancement of cardiovascular function in prehypertensive males.
서론
전 세계의 고혈압 인구는 지속적으로 증가되어 10억 명 이상으로 추정되고, 각종 심혈관질환과 대사질환의 원인이 되기 때문에 심각한 공중 보건 문제로 대두되고 있다(Fisher & Curfman, 2018). 국내 성인의 경우 약 30%가 고혈압이며, 남성의 유병률(28%)이 여성 유병률(18.6%)보다 더 높은 것으로 보고되었다(Kim et al., 2021). 국내 30~40대 남성은 경제활동의 주요 생산인구로서 직장 생활 내 스트레스, 잦은 음주문화, 흡연, 신체활동 부족, 그리고 과도한 영양섭취 등 건강에 부정적인 생활 습관이 고혈압 유병률을 증가시키고 있다(Oh et al., 2013). 특히, 경계성 고혈압(prehypertension)은 수축기혈압(systolic blood pressure: SBP)이 120~139mmHg 또는 이완기혈압(diastolic blood pressure: DBP)이 80~89mmHg에 해당하는 경우로서(Chobanian et al., 2003) 고혈압의 초기 단계에 해당하지만, 사회적으로 경계성 고혈압에 대한 위험 인식이 낮고, 실제로 고혈압으로의 이환율이 정상 혈압자에 비하여 약 2배 높기 때문에(Vasan et al., 2002) 경계성 고혈압자에 대한 적극적인 관리가 요구된다.
고혈압의 예방과 개선을 위하여 규칙적인 운동이 가장 효과적인 방법으로 제안되었다(Semlitsch et al., 2013). 특히, 운동 후 회복기에 나타나는 운동 후 저혈압(post-exercise hypotension: PEH) 반응은 일회성 운동 후 혈압이 안정시 수준 이하로 지속해서 감소되는 현상으로, 고혈압자에게 있어서 장기간의 운동 트레이닝 중 누적되어 나타나 혈압을 감소시키는 주요 기전으로 보고되었다(Forjaz et al., 2000). 초기 연구에서 20~60분의 운동 후 PEH가 10~170분에 걸쳐 나타났으며, PEH의 지속 시간은 운동강도에 따라 결정되는 것으로 보고되었다(MacDonald, 2002). 이후 다양한 운동의 유형과 강도가 PEH에 미치는 영향을 규명하는 연구가 수행되어 왔다. 유산소운동은 저항성운동보다 PEH를 증가시키는데 더 효과적이었고(Keese et al., 2011), 최대산소섭취량(maximal oxygen consumption: VO2max)의 60%로 실시하는 중강도 지속적 운동(moderate-intensity continuous exercise: MICE)이 VO2max의 40%로 실시하는 저강도 지속적 운동에 비하여 더 큰 PEH 반응을 유도하였다(Pescatello et al., 2004).
한편, MICE와 유사한 이점을 제공하면서 시간적 효율이 좋고, 더 즐거운 운동으로 인식되는 고강도 인터벌 운동(high-intensity interval exercise: HIIE)이 심혈관질환의 개선을 위하여 새롭게 제시된 연구(Guiraud et al., 2012)를 전후하여 MICE와 HIIE 처치가 PEH에 미치는 영향을 비교한 연구가 수행되었다. 이와 관련하여 Way et al.(2019)은 HIIE 처치가 MICE 처치보다 더 큰 PEH 반응이 나타났다고 보고하면서, 이는 HIIE 처치가 MICE 처치보다 무산소성 역치 수준과 최대산소섭취 능력을 더 향상시켜 나타난 결과라고 해석하였다. 또한, Pimenta et al.(2019)은 약물 치료를 받는 고혈압자에게 처치한 VO2max 85~95%의 HIIE 처치가 VO2max 60~70%의 MICE 처치에 비하여 더 큰 PEH 반응을 유도하였다고 보고하면서, 고강도 운동이 중강도 운동에 비하여 고혈압의 개선에 더 효과적이라고 주장하였다. 반면, Lacombe et al.(2011)은 고혈압자를 대상으로 수행한 연구에서 VO2max 60%의 MICE 처치와 VO2max 85%의 HIIE 처치 간에 PEH 반응의 차이가 나타나지 않았다고 보고하였고, Jones et al.(2021)은 정상 혈압자에게 최대심박수(maximal heart rate: HRmax)의 65%로 실시한 MICE 처치와 HRmax의 90%로 실시한 HIIE 처치가 유사한 PEH 반응을 보였다고 보고하였다. 전술한 바와 같이 지금까지 수행된 HIIE 처치와 MICE 처치가 PEH에 미치는 영향을 규명한 연구에서는 다소 상반된 결과가 도출되었다. 연구마다 다른 결과가 도출된 원인은 연구 간 대상자의 차이, 운동강도의 차이, HIIE 처치와 MICE 처치의 강도를 설정하는 기준(VO2max와 HRmax)의 차이, 그리고 HIIE 처치와 MICE 처치를 에너지소비량 측면에서 동질화 하였는지 여부 등이 있다고 판단된다.
이상에서 기술한 바와 같이, 일회성 운동 후 나타나는 PEH는 고혈압자의 혈압 강하에 중요한 기전이기 때문에 PEH를 증가시키기 위한 다양한 운동 유형, 강도, 그리고 시간에 대한 연구가 이루어져 왔으며, 그 일환으로 HIIE와 MICE의 효과를 비교하는 연구가 수행되어왔다. 그러나 HIIE와 MICE가 PEH에 미치는 영향에 대한 명확한 결론이 도출되지 못한 상황이고, 연구 간 방법의 차이가 그 원인이기 때문에 연구방법을 표준화한 추가 연구가 필요하다. 따라서 선행 연구들의 단점을 보완하여 VO2max를 기준으로 운동강도를 설정하고, 운동 중 에너지 소비량을 동질화시켜 MICE 처치와 HIIE 처치 간의 차이를 비교 분석하는 연구가 요청되며, 아울러 운동 후 혈압에 더하여 운동 후 심혈관기능의 변화를 분석함으로써 HIIE와 MICE의 효과를 보다 종합적으로 파악하는 연구가 요구된다. 따라서 이 연구의 목적은 운동 중 에너지 소비량이 동질화된 MICE와 HIIE 처치가 30대 경계성 고혈압 남성의 운동 후 혈압과 심혈관기능에 미치는 영향을 규명하는 것이다.
연구 방법
연구 대상자
이 연구의 대상자는 G도 S시에 거주하는 30대 남성으로서, SBP가 120~139mmHg 또는 DBP가 80~89mmHg(Chobanian et al., 2003)에 해당되는 경계성 고혈압자였다. 이들은 최근 6개월 내에 체계적인 운동 경험이 없었고, 각종 질환으로 인하여 약을 복용하지 않았으며, 비흡연자이었다. 이 연구의 대상자 수는 G*Power 3.1을 사용하여 산출하였다(Faul et al., 2009). 효과크기(f) .4, 유의수준(α) .05, 그리고 검정력(1-β) .8을 적용하였을 때 8명으로 산출되었고(MacDonald et al., 2000), 탈락률을 고려하여 총 12명의 대상자를 모집하였으나, 실험 과정에서 1명이 탈락하여 11명의 대상자를 최종 분석에 포함시켰다.
이 연구는 K대학교 생명윤리위원회로부터 승인을 받았으며(승인번호: KHGIRB-21-276), 참여 전 연구 목적과 실험 절차에 대하여 충분히 설명한 후 자발적으로 참여하고자 하는 자로부터 검사 동의서를 받고 실험을 진행하였다. 연구 대상자의 신체적 특성은 <Table 1>에 제시된 바와 같다.
실험 절차
이 연구의 실험은 1회의 예비실험과 2회의 본실험으로 구성되었다. 예비실험 시 최대운동부하검사를 통하여 VO2max를 측정하였고, 이를 근거로 하여 본실험에서 처치할 운동 중의 에너지소비량을 산출하였다. 본실험 중 모든 대상자는 counterbalanced order에 따라 MICE 처치와 HIIE 처치에 반복 참여하였고, 두 처치모두 운동 중 에너지소비량을 동질화시켰으며, 두 처치 간에는 1주일의 wash-out을 두었다.
MICE 처치 중 대상자는 트레드밀에서 VO2max 69~71% 강도로 30분간 운동을 하였다. HIIE 처치 중에는 대상자가 VO2max 49~51% 강도로 첫 2분간 운동을 한 후, VO2max 89~91%와 49~51% 강도로 각각 4분씩 번갈아가면서 지속하여 총 30분간 운동을 하였다. 두 가지의 운동 간에 에너지소비량에서 유의한 차이가 나타나지 않았다(p=.091)(Way et al., 2019). 각 운동 전 30분 동안 안정을 취한 후에 안정시 수치를 측정한 다음, 30분씩 운동을 한 후에 혈압 변인은 회복기 5분, 10분, 15분, 30분, 45분, 그리고 60분의 시점에 측정하였고(MacDonald et al., 2000), 심혈관기능 변인은 회복기 15분, 30분, 45분, 그리고 60분의 시점에서 측정하였다.
측정 항목과 방법
이 연구의 모든 실험은 G도 S시에 소재한 K대학교 운동처방실에서 진행하였다. 대상자는 방문 48시간 전부터 음주와 고강도 운동의 금지, 24시간 전부터 카페인 섭취의 제한, 8시간 이상의 공복, 그리고 7시간 이상 숙면의 조건을 지킨 상태로 오전 8시까지 실험실에 도착하도록 하였다. 구체적인 측정 항목과 방법은 다음과 같다.
1. 체격
신장과 체중은 신체구성 측정기(X-Scan plus Ⅱ, Jawon Medical, Seoul, 한국)로 측정하였다. 체질량지수(kg·m-2)는 체중(kg)을 신장의 제곱(㎡)으로 나누어 산출하였다.
2. VO2max와 운동중 에너지소비량
VO2max를 측정하기 위하여 트레드밀(Series 2000, Marquette Electronics, Milwaukee, WI, 미국)과 가스분석기(Ultima CPX, Med Graphics, Saint Paul, MN, 미국), 그리고 심박수 측정기(M200, Polar Electro Oy, Kempele, 핀란드)를 사용하여 Bruce protocol에 따라 최대운동부하검사를 실시하였다. 검사 중 운동강도가 증가해도 심박수(heart rate: HR)와 산소소비량이 증가되지 않는 경우, 운동 자각도(rating of perceived exertion)가 19 이상인 경우, 호흡교환율(respiratory exchange ratio)이 1.15를 초과하는 경우, 그리고 HR이 HRmax의 90% 이상인 경우 중 세 가지 이상에 해당될 때 검사가 제대로 성립되었다고 판단하였다.
운동 중 에너지소비량은 American College of Sports Medicine (2018)에서 제시한 계산식을 사용하여 대상자마다 산출하였으며, MICE와 HIIE 처치의 에너지소비량을 동질화하였다. 운동 중 에너지소비량의 계산 공식은 다음과 같다.
▶ 총 산소소비량(ml·kg-1·min-1) = 3.5 + (0.2 × 속도) + (0.9 × 속도 ×경사)
▶ 운동 중 산소소비량(ml·kg-1·min-1) = 총 산소소비량 – 3.5
▶ 분당 산소소비량(L·min-1) = 운동 중 산소소비량 (ml·kg-1·min-1) × 체중(kg) / 1,000
▶ 분당 에너지소비량(kcal·min-1) = 분당 산소소비량(L·min-1) × 5(kcal·L-1)
▶ 운동 중 에너지소비량(kcal) = 분당 에너지소비량(kcal·min-1) × 운동시간(min)
3. 안정시와 회복기 혈압
혈압은 대상자를 앉은 자세에서 수동식 수은혈압계(Yamasu, Saitama, 일본)와 청진기(stethoscope)를 사용하여 측정하였고, 오차를 줄이기 위해서 동일한 측정자가 같은 시간 때에 최대한 일정한 온도와 습도를 유지한 상태로 측정하였다. SBP와 DBP를 1분 간격으로 2회 측정한 후 평균값을 산출하였다. 평균동맥압(mean arterial pressure: MAP)과 rate pressure product(RPP)는 다음의 공식을 사용하여 산출하였다.
▶ MAP = [SBP - DBP / 3] + DBP
▶ RPP = HR × SBP
4. 안정시와 회복기 심혈관기능
심혈관기능은 대상자가 누운 자세에서 Physioflow(PF-05, Manatec Biomedical, Paris, 프랑스)를 사용하여 측정하였다. 여섯 개의 전극을 경동맥과 심장 부위에 붙여 HR, 1회박출량(stroke volume: SV), 그리고 심박출량(cardiac output: CO)을 측정하였다. 총혈관전도력(total vascular conductance: TVC)과 총말초저항(total peripheral resistance: TPR)은 다음의 공식을 사용하여 산출하였다.
▶ TVC = CO / MAP
▶ TPR = MAP / CO
자료처리 방법
이 연구에서 얻은 모든 결과는 SPSS PC+ for Windows(version 26.0)로 분석하였다. 기술통계값을 제시하기 위하여 평균(mean)과 표준오차(standard error of mean: SE)를 산출하였다. 두 처치에서 안정시(baseline)와 비교하여 시기간 유의한 차이가 나타날 경우 일원변량분석(repeated one-way ANOVA)으로 분석하였고, 사후검증을 위하여 최소유의차 검증법(least significant difference: LSD)을 실시하였다. 두 처치간 유의한 차이가 나타날 경우 비모수 검정방법인 Wlicoxon 부호순위 검정을 사용하여 종속 t-검정(independent t-test)으로 분석하였다. 모든 통계분석의 유의수준(α)을 .05로 설정하였다.
연구 결과
혈압
MICE와 HIIE 처치에 따른 안정시와 회복기 중 SBP와 DBP의 변화는 <Table 2>와 <Figure 1>에 제시된 바와 같다. SBP가 HIIE 처치에서 안정시와 비교하여 운동 후 회복기 30분과 45분 시점에서 유의하게 낮았으며, HIIE 처치가 MICE 처치보다 운동 후 회복기 10분, 15분, 그리고 30분 시점에서 유의하게 낮았다.
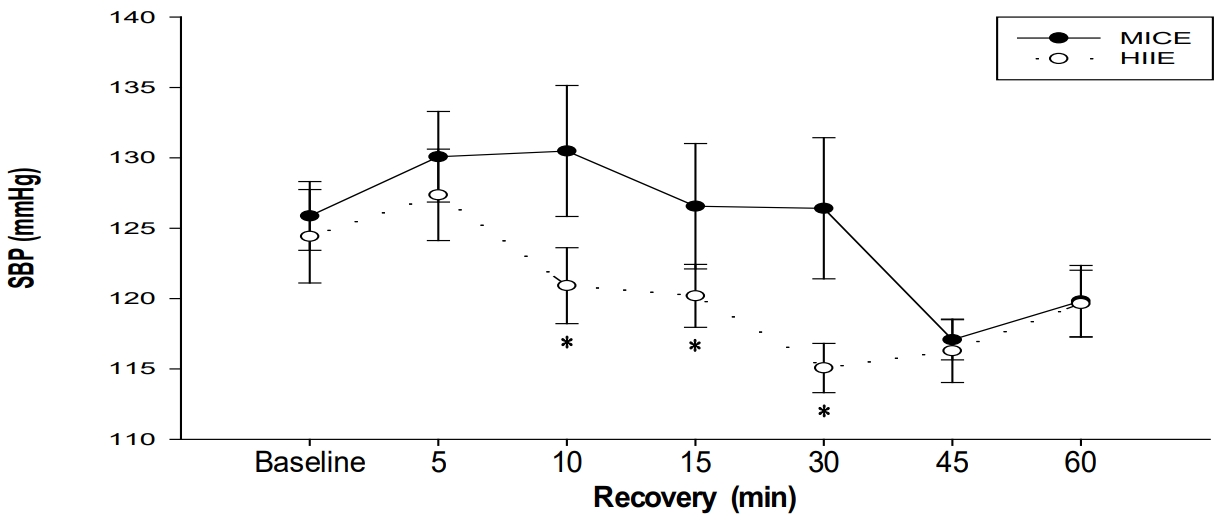
Systolic blood pressure (SBP) at baseline and during recovery phase (*: Significant difference between trials)
MICE와 HIIE 처치에 따른 안정시와 회복기 MAP와 RPP의 변화는 <Table 3>과 <Figure 2>에 제시된 바와 같다. RPP는 MICE와 HIIE 처치 모두에서 안정시와 비교하여 운동 후 회복기 5분, 10분, 15분, 그리고 30분 시점에서 유의하게 높았으며, HIIE 처치가 MICE 처치보다 운동 후 회복기 15분, 30분, 45분, 그리고 60분 시점에서 유의하게 높았다.
심혈관기능
MICE와 HIIE 처치에 따른 안정시와 회복기 중 HR, SV, 그리고 CO의 변화는 <Table 4>에 제시된 바와 같다. HR은 MICE와 HIIE 처치 모두에서 안정시와 비교하여 운동후 회복기 15분, 30분, 45분, 그리고 60분 시점에서 유의하게 높았으며, HIIE 처치가 MICE 처치보다 운동 후 회복기 15분, 30분, 45분, 그리고 60분 시점에서 유의하게 높았다. SV는 HIIE 처치가 MICE 처치보다 운동 후 회복기 30분 시점에서 유의하게 낮았다. CO는 MICE와 HIIE 처치 모두에서 안정시와 비교하여 운동 후 회복기 15분, 30분, 45분, 그리고 60분 시점에서 유의하게 높았으며, HIIE 처치가MICE 처치보다 운동 후 회복기 15분 시점에서 유의하게 높았다.
MICE와 HIIE 처치에 따른 안정시와 회복기 중 TVC와 TPR의 변화는 <Table 5>에 제시된 바와 같다. TVC는 MICE와 HIIE 처치 모두에서 안정시와 비교하여 운동 후 회복기 15분, 30분, 45분, 그리고 60분 시점에서 유의하게 높았으며, HIIE 처치가 MICE 처치보다 운동 후 회복기 15분과 30분 시점에서 유의하게 높았다. TPR은 MICE와 HIIE 처치 모두에서 안정시와 비교하여 운동 후 회복기 15분, 30분, 45분, 그리고 60분 시점에서 유의하게 낮았으며, HIIE 처치가 MICE 처치보다 운동 후 회복기 15분과 30분 시점에서 유의하게 낮았다.
논의
혈압의 변화
1. SBP와 DBP의 변화
이 연구의 MICE 처치에서는 안정시와 비교하여 SBP의 유의한 감소가 나타나지 않았다. 관련 선행연구에서는 유산소운동 실시 후 SBP의 감소가 약 3mmHg(Kleinnibbelink et al., 2020)~7 mmHg(Pescatello et al., 2015) 감소되는 것으로 보고되었다. 그러나 경계성 고혈압자의 경우 유산소운동 후 SBP의 유의한 감소가 나타나지 않을 수 있고(de Brito et al., 2019), PEH 반응의 측정 시간을 길게 해야만 혈압의 유의한 감소를 관찰할 수 있기 때문에(Eicher et al., 2010) 대상자의 특성이나 측정시간에 따라 MICE 이후 SBP의 유의한 감소가 나타나지 않을 수 있다고 해석된다.
반면, 이 연구의 HIIE 처치에서는 안정시와 비교하여 회복기 30분과 45분 시점에서 SBP가 유의하게 낮은 것으로 나타났다. 이와 관련하여 Eicher et al.(2010)은 운동강도가 10% 증가될 때 마다 SBP가 1.5mmHg 더 감소되었다고 보고하였으며, 이는 고강도의 운동이 더 큰 PEH를 나타낼 가능성이 크다는 것을 의미한다. 고강도 유산소운동인 HIIE는 MICE에 비하여 심혈관계 스트레스를 더 크게 유발시키며, 교감신경계의 활성화를 통하여 카테콜아민을 더욱 많이 분비시킨다. 카테콜아민 증가는 운동 후 말초동맥의 이완을 가져오며, 장기간 유산소운동 실시를 통한 말초혈관 저항력을 감소시켜 운동 후 SBP를 감소시킨다(Pimenta et al., 2019). 따라서 이 연구의 HIIE 처치에서 회복기 중 SBP가 안정시보다 유의하게 낮게 나타난 것은 운동강도가 일정한 MICE 처치보다 HIIE 처치의 고강도 운동구간으로 인하여 압력반사 조절 증가, 혈관 확장 증가 및 혈관 저항 감소 등 복합적인 기전에 기인하여 나타난 것으로 사료된다.
이 연구에서 MICE와 HIIE 처치 간에 SBP를 비교한 결과, 회복기 10분, 15분, 그리고 30분 시점에서 HIIE 처치의 수치가 MICE 처치에 비하여 유의하게 낮은 것으로 나타났다. 이는 앞서 설명한 HIIE 처치의 고강도 운동 구간이 포함되기 때문에 전술한 기전에 의하여 회복기 중 SBP를 더욱 낮추었지만, 그 차이가 오래 지속되지는 못했던 것으로 정리할 수 있다. 이와 같은 결과는 동일한 유산소 운동을 실시하였을 때 운동강도의 차이로 인하여 PEH 반응의 유의한 차이가 나타나더라도 그 차이의 지속시간은 짧으며, PEH의 측정 시간이 길어질수록 유의한 차이가 나타나지 않을 수 있다고 보고한 Eicher et al.(2010) 연구결과와 관련이 있다고 판단된다. 이와 더불어 Jones et al.(2021)의 연구에서는 HIIE 처치에서 고강도 스플린트 구간이 더 많이 포함될수록 PEH의 차이가 유의하게 나타날 수 있다고 보고하였다. 또한 PEH 측정 시간이 40분이 넘어갈 경우, 운동 강도에 따른 차이가 없다고 보고하여 이 연구의 결과와 유사하였다. 따라서 HIIE 처치의 고강도 운동 구간으로 인한 운동강도 차이로 인하여 회복기 초반에는 두 처치 간에 SBP의 유의한 차이가 나타났지만, 측정시간이 길어질수록 유의한 차이가 나타나지 않는 것은 선행연구의 결과와 일치하는 것으로 판단된다.
한편, 이 연구에서 회복기의 DBP는 MICE와 HIIE 처치 모두 안정시와 비교하여 유의한 차이가 나타나지 않았다. 유산소운동을 통한 PEH 반응에서 DBP의 감소량이 SBP의 감소량과 비례한다는 연구결과도 있었지만(Jones et al., 2007), 대부분의 연구에서 유산소운동 후 PEH 반응 중 SBP만 유의하게 감소되는 것으로 보고되었다(Syme et al., 2006; Angadi et al., 2015). 일회성 유산소운동 후 DBP의 감소가 통계적으로 유의하지 않더라도 SBP와 함께 DBP가 2mmHg 이상 감소될 경우, 심혈관질환 유병률이 10% 이상 감소되는 것으로 보고되었다(Whelton et al., 2002). 이와 같은 PEH 반응의 증가가 장기간의 트레이닝 과정에서 누적될 경우 혈압의 감소를 유도하고, 나아가서 심혈관질환으로 인한 사망률 감소에 매우 효과적이기 때문에 임상적으로 큰 의미가 있다. 따라서 경계성 고혈압자에게 있어서 PEH 반응 중 DBP의 유의한 감소를 유도하는 효과적인 운동의 유형과 강도를 규명하기 위한 후속 연구가 요청된다.
2. MAP와 RPP의 변화
MAP는 한 번의 심장주기 동안 대상자의 동맥에 가해지는 평균 압력으로서, CO와 TPR에 의하여 직접적인 영향을 받는다(Berlin & Bakker, 2015). 이 연구에서 회복기의 MAP는 MICE와 HIIE 처치 모두 안정시와 비교하여 유의한 차이를 보이지 않았다. PEH 반응은 MAP의 변화를 의미하기 때문에(de Brito et al., 2019) 안정시에 비하여 회복기 중에 유의하게 낮아질 것으로 기대하였지만, 그와 같은 결과는 나타나지 않았다. 이 연구에서 회복기 중 SBP의 유의한 감소는 나타났지만 DBP의 유의한 감소가 나타나지 않았고, DBP의 영향을 받아 MAP의 유의한 감소가 나타나지 않은 것으로 판단된다. Santana et al.(2013)은 고강도와 중강도 유산소운동을 실시한 결과, 이 연구와 동일하게 DBP와 MAP의 유의한 감소가 나타나지 않았다고 보고하였다.
RPP는 심근의 산소소비량을 평가하는 간접 지표로서 심장에 가해지는 부담을 의미하며, 고혈압자의 RPP 증가는 심혈관질환 유병률과 사망률 증가로 이어진다(Moraes et al., 2012). 이 연구에서 회복기의 RPP는 MICE와 HIIE 처치 모두 안정시와 비교하여 30분까지 유의하게 높았으며, HIIE 처치는 MICE 처치보다 운동 후 회복기 15분, 30분, 45분, 그리고 60분 시점에서 유의하게 높았다. 이와 같은 결과는 HIIE 처치가 고강도 운동 구간이 포함되는 유산소운동이기 때문에 중강도의 MICE에 비하여 회복기 중 HR을 더 크게 증가시키고(Forjaz et al., 2000), 그 결과 RPP를 더 높인 것으로 판단된다.
이상에서 살펴본 내용을 정리하면, 고강도의 HIIE 처치가 중강도의 MICE 처치에 비하여 회복기 중 RPP를 더 크게 증가시킨 반면 PEH를 더 크게 유도하였다. 이는 HIIE가 혈압의 감소에는 도움이 되지만, 심장에 더 큰 부담을 줄 수도 있다는 우려를 갖게 한다. 그러나 고강도 유산소운동으로 인한 사망률이 15,000명 중 1명에 불과한 것(Eicher et al., 2010)을 감안한다면 HIIE 이후 RPP의 증가에 너무 큰 우려를 가질 필요는 없다고 판단된다. 최근 Yakasai et al.(2021)도 중·고강도의 유산소운동이 고혈압자의 혈압 감소와 심혈관기능 개선에 도움을 준다고 보고한 바 있다. 또한 HIIE 처치가 고강도 운동으로 분류되지만, 스플린트 구간에 더하여 저강도 구간도 번갈아가며 포함되기 때문에 생각보다 운동으로 인한 부담감이 크지 않을 가능성이 높다. 이는 MICE와 HIIE 두 처치의 운동 중 HR의 유의한 차이가 없는 것으로 설명된다. 따라서 향후 혈압의 감소에 더 효과적이면서 안전에도 큰 문제가 없는 HIIE 처치를 고혈압자에게 보다 적극적으로 처방할 필요가 있다고 사료된다.
심혈관기능의 변화
1. HR과 SV 및 CO의 변화
심장주기의 변동성은 순환 혈액량의 점진적 감소에 대한 초기 보상과 자율신경계 및 혈역학적 반응에 의해 조절되며, 유산소운동의 강도는 심장주기와 HR에 직접적인 영향을 준다(Cooke et al., 2008). 이 연구에서 회복기의 HR은 MICE와 HIIE 처치 모두 안정시와 비교하여 운동 후 회복기 15분, 30분, 45분, 그리고 60분 시점에서 유의하게 높았다. 이와 같은 결과는 운동을 통하여 증가된 심혈관계 스트레스와 자율신경계 활성이 운동 후에도 장시간 유지된 것(O’Sullivan & Bell, 2000)으로 해석될 수 있다. 또한 HIIE 처치의 HR이 MICE 처치보다 운동 후 회복기 15분, 30분, 45분, 그리고 60분 시점에서 유의하게 높았으며, 이는 HR이 운동강도와 비례하여 증가된다는 점, 그리고 고강도 운동이 보다 높은 HR을 발현시키기 위하여 운동 중 심혈관계와 신경계의 자율적 활성을 더욱 증가시킨다는 점(Perini & Veicsteinas, 2003)으로 해석된다. 이 연구에서 얻은 HR의 결과는 운동강도에 비례하여 나타나는 심장 주기의 변동성, 신경의 활성도, 그리고 운동 후 회복기 중 요구되는 산소소비량의 증가에 의해 설명된다고 정리할 수 있다.
SV와 CO는 HR에 대한 혈역학적 보상에 의하여 나타나며, 운동강도에 비례하여 반응하는 것으로 보고되었다(Crisafulli et al., 2011). SV와 CO는 운동 중 근육으로 전달되는 혈류량을 적절하게 유지하기 위하여 사용되는 근육의 개입 정도에 비례하여 증가될 수 있다(MacDonald, 2002). 이 연구의 회복기 중 SV는 안정시와 비교하여 시기 간에 유의한 차이가 나타나지 않았지만, HIIE 처치가 MICE 처치보다 운동 후 회복기 30분 시점에서 유의하게 낮은 것으로 나타났다. SV는 HR과 반비례 관계를 보이기 때문에(Murrell et al., 2011) 회복기 중 HIIE 처치에서 더욱 높아진 HR에 따라 SV가 더 낮아진 것으로 판단된다. 운동 중에는 정맥혈 회귀, 정맥의 수축력, 그리고 심실의 수축력이 증가되어 SV가 증가되지만(Joyce & Wang, 2021), 회복기 중에는 HR의 증가가 더 크기 때문에 상대적으로 낮은 수준의 SV만으로도 적절한 혈류를 공급할 수 있게 되는 것이다. HIIE 처치 후 회복기 30분 시점에서 HR이 MICE 처치에 비하여 더 높았기 때문에 SV가 30분 시점에서 유의하게 낮았던 것으로 판단된다.
한편, CO는 MICE와 HIIE 처치 모두 안정시와 비교하여 회복기의 모든 시점에서 유의하게 높게 나타났으며, HIIE 처치가 MICE 처치보다 운동 후 회복기 15분 시점에서 유의하게 높았다. CO는 SV와 HR의 곱으로 산출되고, 운동강도의 증가에 따라 올라가는 HR 및 교감신경계의 활성도와 직접적으로 관련 있으며, 특히 고강도의 운동 중에는 SV보다 HR에 의하여 결정된다(Dunn et al., 2016). 따라서 이 연구에서 나타난 HR의 변화와 유사하게 CO 또한 회복기 중에 증가된 것으로 해석된다.
2. TVC와 TPR의 변화
이 연구의 TVC는 안정시와 비교하여 MICE와 HIIE 처치 모두 운동 후 회복기 15분, 30분, 45분 그리고 60분 시점에서 유의하게 높았다. 운동을 통한 CO의 변화와 PEH 반응은 TVC에 직접적인 영향을 미치며, CO의 증가와 혈압의 감소는 TVC의 증가를 의미한다(Jones et al., 2007). 따라서 이 연구의 MICE와 HIIE 처치 모두에서 안정시와 비교하여 CO의 유의한 증가와 SBP의 유의한 감소가 나타나 TVC 또한 유의하게 증가된 것으로 해석된다. 또한 처치 간 비교에서는 HIIE 처치가 MICE 처치보다 회복기 15분과 30분 시점에서 유의하게 높은 것으로 나타났다. 이는 HIIE 처치가 동적 운동 중 MICE 처치보다 개입되는 근육량이 더 많고, 이로 인하여 사지의 혈관 확장과 혈액의 관류량이 더 증가되어 나타난 것으로 판단된다(Endo et al., 2012). 즉, 이 연구의 HIIE 처치가 MICE 처치보다 요구되는 근육량과 혈역학적 보상 정도가 높아 MICE 처치보다 더 높은 TVC 결과를 유도했다고 판단된다.
TPR은 운동강도에 비례하여 변화되는 CO와 MAP에 의하여 결정되며, PEH 반응의 복합적인 기전에 의하여 발현된다(MacDonald, 2002). 이 연구의 TPR은 안정시와 비교하여 MICE와 HIIE 처치 모두에서 회복기 15분, 30분, 45분, 그리고 60분의 시점에서 유의하게 낮았다. 이와 같은 결과는 운동 후 혈압이 감소되는 PEH 반응과 운동 후에도 증가된 상태로 유지되는 CO의 반응으로 나타나며(Jones et al., 2007), PEH 반응이 혈관 확장 기전으로 인한 CO의 증가와 TPR의 현저한 감소로 나타난다는 Kleinnibbelink et al.(2020)의 보고와 관련이 있다. 또한 운동강도의 증가는 HR의 증가를 통하여 CO를 증가시키며, PEH 반응과 결합되어 TPR을 유의하게 감소시킨다(Gjøvaag et al., 2020). 이 연구에서는 MICE와 HIIE 처치 모두 안정시와 비교하여 운동 후 HR이 유의하게 증가되었고, CO 또한 유의하게 증가됨으로써 TPR이 유의하게 낮게 나타난 것으로 해석된다.
한편, 처치 간에 비교한 결과 HIIE 처치가 MICE 처치보다 운동 후 회복기 15분과 30분 시점에서 유의하게 낮은 것으로 나타났다. 이와 같은 결과는 전술한 TVC 결과와 함께 이해할 필요가 있다. HIIE는 고강도 운동으로 체내 혈액 요구량을 더욱 증가시킴으로써 MICE 처치보다 회복기 15분 시점에서 CO가 유의하게 높았고, 이에 따라 회복기 15분과 30분 시점에서 TVC의 증가와 TPR의 감소가 함께 나타난 것으로 판단된다. 이는 고강도 운동으로 인하여 심혈관 스트레스가 증가되면, 교감신경계 활성화 및 말초 동맥의 이완이 활발해져 PEH 반응이 증가된다는 선행연구의 결과(O’Sullivan & Bell, 2000)와도 관련이 있다. 실제로 이 연구의 SBP는 HIIE 처치가 MICE 처치보다 회복기 10분, 15분, 그리고 30분 시점에서 유의하게 낮았는데, 이 시점은 PEH의 반응과 밀접한 관련이 있는 CO, TVC, 그리고 TRP의 유의한 차이가 나타난 시점과 일치한다. 이와 같은 결과는 일회성 운동강도에 따른 다양한 PEH 반응이 MAP, CO, 그리고 TPR의 영향을 받는다는 Sabbahi et al.(2016)의 보고와도 관련이 있는 것으로 판단된다.
결론
이 연구에서는 11명의 30대 경계성 고혈압 남성이 VO2max 70% 강도의 MICE 처치와 VO2max 50% 및 90% 강도의 HIIE 처치에 반복 참여하였으며, 안정시와 회복기 중 혈압과 심혈관기능을 측정하였다. 그 결과 HIIE 처치가 MICE 처치보다 운동 후 회복기 중 심혈관 스트레스가 높았지만, 고강도 스플린트 구간의 포함으로 인하여 PEH 반응의 증대와 심혈관기능의 개선에 더 효과적이었다고 결론지을 수 있다. 따라서 30대 경계성 고혈압 남성의 혈압 조절과 심혈관기능 개선에 HIIE를 보다 적극적으로 적용할 필요가 있다고 판단된다. 향후 경계성 고혈압 남성을 대상으로 HIIE 트레이닝과 MICE 트레이닝의 혈압 강하 효과를 종단적으로 비교하는 후속 연구가 요청되며, 고혈압 환자, 여성, 그리고 다른 연령대 등 다양한 대상자를 포함하여 효과를 검증하는 후속 연구 또한 요청된다.