트레드밀 운동이 streptozotocin 뇌실 처치로 유발된 알츠하이머 동물 모델 쥐의 신경염증과 신경세포사멸에 미치는 영향
The effect of treadmill exercise on neuroinflammation and neuronal cell death in intracerebroventricular streptozotocin-induced cognitive impairment in rats
Article information
Abstract
본 연구는 뇌실(intracerebroventricular; ICV)에 streptozotocin(STZ) 처치로 유도된 알츠하이머 동물 모델 쥐를 대상으로 6주간의 트레드밀 운동이 별아교세포(astrocyte)에서의 염증반응, 해마 부위에서 염증관련 단백질과 신경세포의 사멸에 미치는 영향을 알아보았다. 실험동물은 Sham-CON(n=10), ICV-STZ CON(n=10), ICV-STZ TE(n=10)로 구분하였다. 트레드밀 운동은 하루에 30분, 주5일, 6주간 실시하였다. 먼저 수중미로검사에서 ICV-STZ CON 집단은 Sham-CON 집단에 비해 원형도피대를 찾는 시간과 거리가 유의하게 증가된 것으로 나타났다. 하지만 트레드밀 운동을 실시한 ICV-STZ TE 집단은 ICV-STZ CON 집단에 비해 원형도피대를 찾는 시간과 거리가 유의하게 감소된 것으로 나타났다. 별아교세포의 marker인 신경아교원섬유성산성단백질(glial fibrillary acidic protein; GFAP)의 경우 ICV-STZ CON 집단은 Sham-COM 집단에 비해 발현이 증가되었지만 ICV-STZ TE 집단은 ICV-STZ CON 집단에 비해 감소된 것으로 나타났다. 염증반응과 관련해서 ICV-STZ CON 집단은 Sham-CON 집단에 비해 TNF-α, IL-1β, Lipocalin-2, COX-2의 발현이 증가한 것으로 나타났지만 ICV-STZ TE 집단은 ICV-STZ CON 집단에 비해 감소된 것으로 나타났다. 신경세포의 사멸과 관련해서 ICV-STZ CON 집단은 Sham-CON 집단에 비해 caspase-3 와 Bax의 발현이 증가하였지만, Bcl-2는 감소한 것으로 나타나 신경세포의 사멸이 증가하는 것으로 나타났다. 하지만, 트레드밀 운동을 실시한 ICV-STZ TE 집단은 ICV-STZ CON 집단에 비해 신경세포의 사멸이 감소하는 것으로 나타났다. 따라서 본 연구에서 실시한 트레드밀 운동은 알츠하이머 동물 모델 쥐의 인지능력 저하의 개선, 염증반응의 감소 그리고 신경세포의 사멸을 억제하는 긍정적인 효과가 있는 것으로 나타났다. 즉 트레드밀 운동과 같은 유산소 운동은 알츠하이머 질환의 증상을 개선하기 위한 효과적인 대안으로 적용될 수 있다.
Trans Abstract
The purpose of this study was to explore the effects of 6-week treadmill exercise on inflammation and neuronal cell death in the hippocampus of intracerebroventricular (ICV) streptozotocin (STZ)-injected Alzheimer's disease (AD) rats. The experimental animals were divided into Sham-CON group (n=10), ICV-STZ CON group (n=10) and ICV-STZ TE group (n=10). The treadmill exercise was conducted for 30 minutes a day, 5 days a week, for 6 weeks. First, in a water maze test, it turned out that the time and distance of finding an escape platform significantly increased in the ICV-STZ CON group as compared to those in the Sham-CON group. In contrast, it turned out that the time and distance of finding the escape platform significantly decreased in the ICV-STZ TE group in which the treadmill exercise was carried out as compared to those in the ICV-STZ CON group. The expression of marker of astrocytes, Glial Fibrillary Acidic Protein (GFAP) increased in the ICV-STZ CON group as compared to that in the Sham-COM group, but that in the ICV-STZ TE group decreased as compared to that in the ICV-STZ CON group. Regarding inflammatory reactions, it turned out that the expressions of TNF-α, IL-1β, Lipocalin-2 and COX-2 increased in the ICV-STZ CON group as compared to those of the Sham-CON group, but it turned out that those of the ICV-STZ TE group decreased as compared to those of the ICV-STZ CON group. Regarding neuronal cell deaths, the expressions of caspase-3 and Bax increased in the ICV-STZ CON group as compared to the Sham-CON group, but it turned out that the expression of Bcl-2 decreased, and the neuronal cell deaths increased. However, it turned out that the neuronal cell deaths decreased in the ICV-STZ TE group in which the treadmill exercise was carried out as compared to that in the ICV-STZ CON group. Therefore, it turned out that the treadmill exercise showed positive effects on improving cognitive ability by reducing inflammatory reactions and inhibiting neuronal cell deaths in the rats with AD. In other words, aerobic exercise like treadmill exercise can be applied as an effective alternative to improve symptoms of AD.
서론
알츠하이머 질환(Alzheimerʼs disease; AD)의 연구에 있어서 많은 학자들의 관심은 세포 밖에 축적되는 아밀로이드 플라크 (amyloid plaque), 세포 내에 형성되는 신경 섬유 엉킴 (neurofibrillary tangle)의 생성과 분해에 관여하는 단백질의 기능을 분석하는 것이었다. 이러한 이유로 신경교세포의 증식과 면역-염증반응의 증가는 신경세포의 사멸에 따른 이차적 반응으로 여겨져 왔다. 하지만 많은 연구를 통해 면역-염증 반응이 신경계 소실에 따른 이차적 현상이 아니고 알츠하이머 질환의 초기에 관여할 수도 있고 신경세포의 생존과 사멸에 중요한 역할을 한다는 증거들이 제시되고 있으며(McGeer & McGeer, 2002; Popovic et al., 1998), 만성염증이 AD와 같은 퇴행성 신경 질환에 중요한 역할을 담당한다고 알려져 있다(Cuello et al., 2010; Haass & Selkoe, 2007).
이러한 신경염증은 미세아교세포(microglia)와 별아교세포(astrocyte)와 같은 신경교세포(glial cells)가 산화적 스트레스에 대하여 지속적으로 활성화 될 때 진행되는 것으로 알려져 있다(Fuller et al., 2010). 활성화된 별아교세포는 염증반응을 유도하는 사이토카인 (proinflammatory cytokine)을 분비를 촉진하고, 이후에는 활성산소 및 자유기 손상(oxidative stress and free radical injury)의 증가와(Wang et al., 2005) caspase의 활성이 증가되어 세포의 항상성유지 등과 관련된 단백질들 파괴시키거나 관련 단백질을 활성화시켜 신경세포의 사멸을 유도한다(Niu, et al., 2010; Rohn, 2010).
특히 AD에서 Tumor necrosis factor-alpha (TNF-α), Interleukin-1alpha (IL-1α), IL-1β, IL-6, Macrophage inflammatory protein-1α, acute phase protein, C-reactive protein(CRP) 와 같은 염증성 사이트카인(Inflammatory cytokine)이 과잉 발현되고 특히 IL-1은 amyloid plaque 와 neurofibrillary tangle 의 생성을 가속화 시키는 것으로 보고되고 있다(Wood et al., 1993). 또한 AD의 뇌 조직에서 Cyclooxygenase-2 (COX-2) 단백질의 발현이 증가되어 있고 이는 아밀로이드 베타 (Amyloid-β; Aβ)의 양과 관련이 있고(Hirst et al., 1999), COX-2의 과발현은 신경세포사멸을 유도한다(Graham & Hickey, 2003). Yoshiyama 등 (2007)은 타우병증 P301S 형질전환 동물을 대상으로 한 연구에서 neurofibrillary tangle의 생성 이전에 microglia 가 활성화 된다는 사실을 보고하였다. 활성화된 microglia 가 neurofibrillary tangle에 직간접적으로 관여한다는 중요한 사실을 알 수 있다. 즉 초기에는 amyloid plaque 와 neurofibrillary tangle의 생성을 제거하기 위해 염증 반응이 활성화 되지만, 이를 적절하게 제거할 수 없을 때, 염증반응 관련인자의 과잉 발현이 되풀이 되면서 신경세포사멸이 일어나고 알츠하이머 질환은 가속화 되는 것이다.
최근 염증과 관련해서 주목 받고 있는 Lipocalin-2 는 세포의 사멸, 이주, 형태와 같은 다양한 생리적 과정에 관여하며, 염증반응 및 바이러스 감염 시 발현이 증가되는 것으로 알려져 있다(Lee et al., 2009). 또한, 경도인지장애와 같은 AD로 발전할 수 있는 단계에서 Lipocalin-2가 증가하는 것으로 보고되고 있으며(Choi et al., 2011), 신경교세포가 염증성 자극에 의해 활성화될 때 Lipocalin-2 단백질이 분비되는 것으로 알려져 있다. 따라서 Lipocalin-2 단백질이 퇴행성신경질환의 조기 발견과 염증반응에 관련해서 많은 연구들이 진행되고 있다.
현재 AD의 치료와 관련해서 콜린분해억제제(Choline esterase inhibitors-ChEi; galantamine, donepezil, rivastigmine)를 처방하고 있는데, 이들 약물의 효과는 초기에 단기간 완화시키는 것 외에 미미하다고 알려져 있으며, 부작용도 발생한다고 보고되고 있다(Birks, 2006; Grutzendler & Morris, 2001). 약물요법의 부작용을 최소화하면서 AD 증상을 개선하는 대체요법으로 신체활동과 같은 운동이 효과적인 방법으로 제시되고 있다. 운동은 코티졸 분비를 감소시켜 스트레를 예방하고(Kalmijn et al., 1998), 뇌에 혈액, 산소 그리고 영양분의 공급을 증가시킨다(Black et al., 1991; Gómez-Pinilla et al., 1998). 또한 신경인자를 자극하여 신경세포의 성장과 생존에 긍정적인 영향을 미치는 것으로 보고되고 있다(Cotman & Berchtold, 2002). 결과적으로 신체활동과 같은 운동은 인지기능의 회복과 저하를 막아 AD발생을 예방하거나 진행을 지연시키는 긍정적인 효과가 있는 것으로 보고되고 있다.
이처럼 운동이 AD의 뇌 기능을 개선하고 긍정적인 영향을 미치는 여러 연구들이 보고되고 있지만, 운동이 별아교세포와 같은 신경교세포에서의 염증반응과 이에 따른 신경세포의 사멸을 분석한 연구는 많이 부족한 실정이다.
따라서 이 연구는 6주간 트레드밀 운동이 뇌실(ICV)내에 streptozotocin(STZ)을 주입하여 인지능력이 저하된 흰쥐를 대상으로 뇌 조직에서 별아교세포에서의 염증반응, 염증관련 단백질 그리고 신경세포의 사멸에 미치는 영향을 알아보고자 하였다.
연구방법
실험동물
본 실험은 H대학교 동물실험윤리위원회에 실험계획서를 제출하여 실험승인을 받았다. 실험에 사용된 동물은 20주령의 Sprague-Dawley 암컷 흰쥐(n=30)로 H대학교 동물실험실에서 사육하였다. 실험동물은 1964년 발표한 헬싱키 선언에 근거한 Guiding Principles for the care and Use of Animal에 따라 12시간 간격으로 명암을 유지시키고 사육장의 실내온도는 22∼24℃로 하고 상대 습도는 40∼60%로 유지하였다. 실험동물은 사육기간 동안 식이와 음수는 자유 공급하였으며, 케이지 마다 2마리씩 분산하여 사육하였다. 실험동물은 Sham-CON, ICV-STZ CON, ICV-STZ Treadmill exercise (TE)으로 구분하고 각각 10마리씩 무선 배정하였다.
ICV-STZ 처치
본 연구에서는 인지능력 손상 쥐를 만들기 위해 이희혁 등(2009)의 수술방법을 활용하였다. 실험동물의 두부를 stereotaxic frame에 고정하고 뇌실 내에 STZ를 주입하였다. 두개골 표면에서 정수리점(bregma)을 기준으로 우측 1.5 mm, 후측 0.8 mm되는 지점의 두개골을 직경 0.5 mm인 소형 드릴로 천공한 후 미량주입기 (10㎕, 26 G, Hamilton. USA)를 깊이 3.6 mm 자침하여 Saline에 STZ을 체중당 1.5mg으로 희석시킨 후 각각 10㎕씩 총 20㎕ 용량을 주입하고, 대조군에는 동일한 방법으로 saline만을 주입하였다.
운동프로그램
운동집단의 실험동물은 ICV-STZ 처치 후 3일간의 안정화 기간을 거친 후에 실험동물용 트레드밀(Rodent, Treadmill, Dae-myung Scienific Co, Ltd, Korea)을 이용하여 점진적 부하의 트레드밀 운동을 실시하였다.1주간의 사전 적응훈련(경사도 0%, 운동시작 5분 2m/min, 다음 5분 5m/min, 마지막 20분 8m/min)을 실시하였다. 사전 적응훈련을 마친 후 본 운동은 주 5일, 6주간 실시하였다. 경사도를 0%로 고정시킨 후에 운동시작 5분 동안 8m/min, 다음 5분은 11m/min, 마지막 20분은 14m/min 속도로 실시하였다. 본 연구에서 활용한 운동 프로토콜은 Kim 등(2003)과 이희혁 등(2009)이 제시한 중강도 운동 프로그램을 바탕으로 실시하였다.
수중미로검사
수중미로검사는 창문과 공기가 잘 통하고 실험 테이블이 준비된 실험실에서 실시하고, 장비로는 원형수조(지름 1.5m × 높이 12cm) 안에 표적(target)이 보이지 않도록 하기 위해 수조안에 물(22℃- 25℃)을 받아 전지분유를 풀어 넣어 용해시킨 후 물표면 바로 1cm 정도 떨어진 수조바닥에 표적(지름 12cm)을 놓는다. 수영거리(escape distance), 수영시간(escape latency)을 수조 바로 위 천정에 설치 연결된 컴퓨터 프로그램인 SMART-CS 프로그램(Panlab, Barcelona, Spain)을 활용하여 측정⋅분석하였다. 수중미로검사는 트레드밀 운동이 끝난 후 5일 동안 실시하고 매일 같은 위치에서 출발하여 3회씩 동물이 동일한 위치에 놓인 원형도피대에 도달하도록 연습시킨 후 마지막 6일째 원형도피대를 없앤 후 동일한 출발 위치에서 수영을 시작하여 3회 도달한 결과를 실험결과 값으로 활용하는데 이때, 실험결과 값으로 60초 이내에 숨겨진 표적을 찾을 경우에만 활용하고 각 검사는 최소한 5분간의 간격을 두고 실시하였다.
뇌 조직 적출
6주간의 트레드밀 운동이 끝나고 24시간 뒤에 럼푼/졸리틸 혼합액(2:1, 10mg/kg)을 복강 내 주사하여 마취한 후 단백질 발현 측정을 위한 실험동물(n=6)은 뇌 조직을 적출하였다. 적출한 뇌 조직은 대뇌피질과 해마를 분리한 후 액체질소에 급냉하여 분석 시까지 -80℃의 초저온 냉동기에 보관하였다. 면역조직화학염색 분석을 위한 실험동물(n=4)은 마취 후 흉강을 열고 좌심실을 통하여 50mM 인산염 완충 식염수를 10분 동안 주입하고, 100mM 인산 완충액에 녹인 4% paraformaldehyde (PFA) 고정액을 관류하였다. 관류 고정 후 뇌를 적출 한 다음 4% PFA 고정액에 담아서 4℃에서 4시간 동안 고정하였다. 고정된 뇌 조직은 30% sucrose 용액에서 2일간 침적시킨 후 Cryostat를 이용하여 40㎛ 두께의 연속관성 절편을 제작하였다(Leica, Nussloch, Germany).
면역조직화학염색
면역조직화학염색을 위해 각 집단 별로 조직을 4장씩 선택 후 자유부유법을 이용하여 0.01M PBS로 10분씩 3번 세척한 후 각 조직을 0.01M Sodium Citrate가 들어있는 Beaker에 넣어 8분간 80°C에 Incubation 시킨 후 40분 동안 10% Normal Donkey Serum으로 Blocking을 실시하였다. Blocking 후 1차항체 anti-GFAP 12시간 동안 4℃에서 Overnight 시킨 후 0.01M PBS에서 5분씩 3번 세척한 후 실온에서 1시간 동안 horseradish peroxidase-conjugated goat anti-mouse로 반응 시켰다. 0.01M PBS로 5분씩 3번 세척한 후 30분 동안 Vectastain-Elite ABC kit 용액으로 상온에서 반응시켰다. 그리고 0.01M PBS에서 5분씩 3번 세척한 후, DAB Peroxidase Substrate Ki(SK-4100, Vector Laboratories, USA)를 사용하여 3,3‘-diaminobenzidine tetrahydrochloride (DAB)를 0.05M tris buffer(pH 7.6)에 0.02%로 희석하고, 0.02%의 과산화수소를 첨가하여 5분 동안 발색하였다.
Western blot
적출된 뇌 조직에서 해마부위만 따로 분리하여 homo- genization buffer와 homogenizer를 이용하여 균질화하였다. 균질액은 4℃에서 15,000rpm 으로 30분간 원심분리한 후 상층액을 Bradford 방법으로 총 단백질량을 정량하였다. 각 샘플을 Mini-Protein Ⅱ dual-slab apparatus(Bio-Rad Laboratories, Hercules, CA, USA)에 준비된 stacking gel well에 총 단백질량이 40㎍이 되도록 분주하고 80Volt에서 2시간 정도 샘플이 바닥에 닿을 때까지 전기영동 하였다. PVDF membrane (Amersham, Arlington Heights, IL, USA)과 Transfer buffer(190mM glycine, 50mM Tris-Base, 0.05% SDS 20% methanol)에 적신 3M paper를 차례로 겹친 다음, Mini transblot module(Bio-Rad Laboratories, Hercules, CA, USA)에 장치하고 60 Volt로 2시간 전사하였다. 1시간 동안 membrane을 3% BSA 용액으로 blocking 시킨 후에 1차 항체를 1 : 1000농도로 blocking(5% BSA)용액에 넣어 12시간 동안 반응시켰다. 다음날 TBS-T용액으로 10분씩 4차례 세척을 실시하였다. 그 후에 각각의 1차 항체에 맞는 2차 항체 (horseradish peroxidase(HRP)-conjugated goat anti-mouse, Santa Cruz Biotechnology, Santa Cruz, CA, USA; HRP-conjugated rabbit anti-goat, goat anti-rabbit, Invitrogen, Carlsbad, CA, USA)를 blocking 용액으로 1 : 5000으로 희석시켜 90분 동안 흔들어주고 TBS-T 용액으로 10분씩 4차례 세척한 다음, 마지막 단계로 Luminata Forte Western HRP substrate 용액(Millipore Corporation, Billerica, MA, USA)에 membrane을 넣고 1분간 발색하여 얻어진 membrane을 이미지 분석 시스템(Molecular Imager ChemiDoc XRS System, Bio-Rad)을 이용하여 스캔한 다음 Quantity One 1-D Analysis Software (Bio-Rad Laboratories, Hercules, CA, USA)를 통해 단백질량을 산출하였다. 이 연구에서 사용한 1차 항체는 <표 1>에 제시하였다.
자료처리 방법
본 연구에서 얻어진 모든 자료는 윈도우용 18.0 SPSS 통계 프로그램을 이용하여 기술 통계치(mean±SD)를 산출하였다. 집단 간 차이 분석을 위해 일원변량분석(one way ANOVA)을 실시하였다. 집단 간 유의한 차이가 있을 경우 Bonferroni 방법을 이용하여 사후 검증을 실시하였다. 이때 통계적 유의수준은 α=.05로 설정하였다.
연구결과
트레드밀 운동이 수중미로검사 결과에 미치는 영향
<그림 1>은 6주간의 트레드밀 운동이 ICV-STZ 흰쥐의 학습과 기억능력에 미치는 영향을 평가하기 위해 실시한 수중미로검사 결과이다.
집단 간 원형도피대를 찾는 시간을 분산분석한 결과 집단 간에 통계적으로 유의한 차이가 있는 것으로 나타났다[F(2, 27)=37.887, p=.001]. 사후검증을 실시한 결과, Sham-CON 집단에 비해 ICV-STZ CON 집단은 원형도피대를 찾는 시간이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.001), ICV-STZ CON 집단에 비해 ICV-STZ TE 집단은 원형도피대를 찾는 시간이 통계적으로 유의하게 감소한 것으로 나타났다(p=.001).
집단 간 원형도피대까지 이동한 거리를 분산분석한 결과 집단 간에 통계적으로 유의한 차이가 있는 것으로 나타났다[F(2, 27)=95.793, p=.001]. 사후검증을 실시한 결과, Sham-CON 집단에 비해 ICV-STZ CON 집단은 원형도피대를 찾는 시간이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.001), ICV-STZ CON 집단에 비해 ICV-STZ TE 집단은 원형도피대를 찾는 시간이 통계적으로 유의하게 감소한 것으로 나타났다(p=.001).
트레드밀 운동이 GFAP에 미치는 영향
<그림 2>은 6주간의 트레드밀 운동이 ICV-STZ 흰쥐의 해마부위에서 별아교세포의 marker로 사용되는 GFAP의 발현을 면역조직화학염색법을 이용하여 확인하였다.
집단 간 GFAP의 발현을 분산분석한 결과 집단 간에 통계적으로 유의한 차이가 있는 것으로 나타났다. [F(2, 9)=53.032, p=.001]. 사후검증을 실시한 결과, Sham-CON 집단에 비해 ICV-STZ CON 집단은 GFAP의 발현이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.001), ICV-STZ CON 집단에 비해 ICV-STZ TE 집단은 GFAP의 발현이 통계적으로 유의하게 감소한 것으로 나타났다(p=.005).
트레드밀 운동이 염증관련 단백질 발현에 미치는 영향
<그림 3>는 6주간의 트레드밀 운동이 ICV-STZ 흰쥐의 해마 부위에서 염증관련 단백질에 미치는 영향을 평가하기 위해 실시한 Western blot 결과이다.
TNF-α의 발현량을 분산분석한 결과 집단 간에 통계적으로 유의한 차이가 있는 것으로 나타났다[F(2, 15)=30.815, p=.001]. 사후검증을 실시한 결과, Sham-CON 집단에 비해 ICV-STZ CON 집단은 발현량이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.001), ICV-STZ CON 집단에 비해 ICV-STZ TE 집단은 발현량이 통계적으로 유의하게 감소한 것으로 나타났다(p=.001).
IL-1β의 발현량을 분산분석한 결과 집단 간에 통계적으로 유의한 차이가 있는 것으로 나타났다[F(2, 15)=10.654, p=.001]. 사후검증을 실시한 결과, Sham-CON 집단에 비해 ICV-STZ CON 집단은 발현량이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.002), ICV-STZ CON 집단에 비해 ICV-STZ TE 집단은 발현량이 통계적으로 유의하게 감소한 것으로 나타났다(p=.007).
Lipocalin-2의 발현량을 분산분석한 결과 집단 간에 통계적으로 유의한 차이가 있는 것으로 나타났다[F(2, 15)=30.062, p=.001]. 사후검증을 실시한 결과, Sham-CON 집단에 비해 ICV-STZ CON 집단은 발현량이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.001), ICV-STZ CON 집단에 비해 ICV-STZ TE 집단은 발현량이 통계적으로 유의하게 감소한 것으로 나타났다(p=.001).
COX-2의 발현량을 분산분석한 결과 집단 간에 통계적으로 유의한 차이가 있는 것으로 나타났다[F(2, 15)=22.624, p=.001]. 사후검증을 실시한 결과, Sham-CON 집단에 비해 ICV-STZ CON 집단은 발현량이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.001), ICV-STZ CON 집단에 비해 ICV-STZ TE 집단은 발현량이 통계적으로 유의하게 감소한 것으로 나타났다(p=.001).
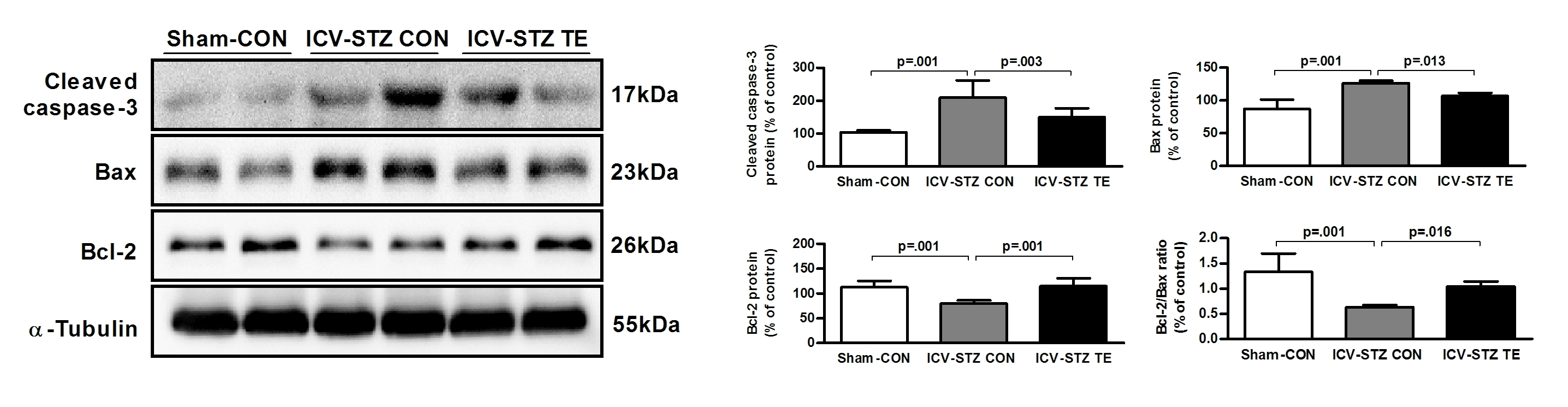
트레드밀 운동이 신경세포 사멸에 미치는 영향
<그림 4>은 6주간의 트레드밀 운동이 ICV-STZ 흰쥐의 해마 부위에서 신경세포사멸에 관련된 단백질에 미치는 영향을 알아보기 위해 실시한 Western blot 결과이다.
Caspase-3의 발현량을 분산분석한 결과 집단 간에 통계적으로 유의한 차이가 있는 것으로 나타났다[F(2, 15)=16.609, p=.001]. 사후검증을 실시한 결과, Sham-CON 집단에 비해 ICV-STZ CON 집단은 발현량이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.001), ICV-STZ CON 집단에 비해 ICV-STZ TE 집단은 발현량이 통계적으로 유의하게 감소한 것으로 나타났다(p=.001).
Bax의 발현량을 분산분석한 결과 집단 간에 통계적으로 유의한 차이가 있는 것으로 나타났다[F(2, 15)=28.920, p=.001]. 사후검증을 실시한 결과, Sham-CON 집단에 비해 ICV-STZ CON 집단은 발현량이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.001), ICV-STZ CON 집단에 비해 ICV-STZTE 집단은 발현량이 통계적으로 유의하게 감소한 것으로 나타났다(p=.013).
Bcl-2의 발현량을 분산분석한 결과 집단 간에 통계적으로 유의한 차이가 있는 것으로 나타났다[F(2, 15)=14.108, p=.001]. 사후검증을 실시한 결과, Sham-CON 집단에 비해 ICV-STZ CON 집단은 발현량이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.001), ICV-STZ CON 집단에 비해 ICV-STZ TE 집단은 발현량이 통계적으로 유의하게 감소한 것으로 나타났다(p=.001). Bcl-2/Bax ratio를 분산분석한 결과 집단 간에 통계적으로 유의한 차이가 있는 것으로 나타났다[F(2, 15)=15.317 p=.001]. 사후검증을 실시한 결과, Sham-CON 집단에 비해 ICV-STZ CON 집단은 발현량이 통계적으로 유의하게 증가한 것으로 나타났으며(p=.001), ICV-STZ CON 집단에 비해 ICV-STZ TE 집단은 발현량이 통계적으로 유의하게 감소한 것으로 나타났다(p=.016).
논의
본 연구는 ICV에 STZ를 처치하여 AD를 유발한 동물을 대상으로 6주간의 트레드밀 운동을 실시하여 학습과 기억능력, 뇌 해마부위에서 미세아교세포와 별아교세포에서의 염증반응, 염증성 사이토카인 그리고 신경세포의 사멸에 미치는 영향을 알아보았다.
먼저, 트레드밀 운동이 실험동물의 학습과 기억력 손상여부를 알아보기 위해 수중미로검사를 실시하였다. 먼저 ICV-STZ CON 집단은 Sham-CON 집단에 비해 원형도피대를 찾는 시간과 이동거리가 유의하게 증가하였으며, ICV-STZ TE 집단은 ICV-STZ CON 집단에 비해 원형도피대를 찾는 시간과 이동거리가 유의하게 감소된 것으로 나타났다. ICV-STZ 처치를 통해 원형도피대를 찾는데 장애가 나타났으며, 이러한 결과는 해마가 손상된 실험동물은 학습과 기억력이 저하된다는 Jolkkonen et al.(2003)의 연구결과와 일치하는 것으로 나타났다. 하지만 트레드밀 운동을 실시한 ICV-STZ TE 집단은 원형도피대를 찾는 시간이 단축된 것으로 나타나 트레드밀 운동이 공간학습과 기억능력을 개선시킨다는 보고와 일치하였다(Dao et al., 2013; Hoveida et al., 2011; Kang et al., 2013). 뇌의 해마는 학습과 기억에 중요한 부위로(Milner et al., 1998), 운동은 해마에서 신경세포의 생성을 증가시켜, 학습과 기억력을 향상(Trejo et al., 2001; van Praag et al., 1999) 시킨다고 알려져 있다. 따라서 본 연구에서 실시한 트레드밀 운동이 ICV-STZ 처치 실험동물의 학습능력, 기억력 그리고 신경가소성을 증가시켜 뇌기능에 개선이 나타난 것으로 생각된다.
AD의 병리학적 특징인 아밀로이드 플라크와 신경 섬유 엉킴은 신경계의 염증반응을 유도한다고 보고되고 있다. 어떠한 자극으로 인해 아밀로이드 플라크의 침적이 증가하면 이를 통해 신경교세포가 활성화되고 염증반응이 일어나는데, 본 연구에서는 ICV-STZ 처치를 통해 뇌 해마 부위에서 별아교세포에서 GFAP의 염색을 통해 세포체와 가지가 두꺼워지고 강하게 염색되는 형태학적 변화가 나타난 것을 확인하였다. 즉 ICV-STZ 처치를 통해 AD에서 나타나는 염증반응이 증가한 것으로 물리적 손상, 신경독성물질을 처치한 실험동물 그리고 AD형질전환 생쥐의 뇌에서 GFAP의 발현이 증가한다는 보고와 일치하는 것으로 나타났다(Grathwohl et al., 2009; Hanzel et al., 2014; Puli et al., 2012; White et al., 2010). 하지만 트레드밀 운동을 실시한 ICV-STZ TE 집단에서 GFAP의 발현이 감소한 것으로 나타났는데 이러한 결과는 tau 형질전환 생쥐를 이용하여 12주 동안 트레드밀 운동을 실시하였을 때 별아교세포에서 GFAP의 발현이 감소하였다는 Leem et al.(2011)의 연구결과와 일치하는 것으로 나타났다.
뇌의 염증상태에서 발견되는 대표적인 염증매개체인 COX-2와 염증성 사이토카인 TNF-α, IL-1β은 AD와 같은 퇴행성 신경 질환에서 발현량이 증가하고 이로 인해 신경세포의 사멸이 유도된다고 알려져 있다(Rubio-Perez & Morillas-Ruiz, 2012). 본 연구의 결과에서도 해마부위에서 단백질을 추출하여 분석한 결과 TNF-α, IL-1β는 ICV-STZ CON 집단에서 발현량이 증가한 것으로 나타났다. 하지만 트레드밀 운동을 실시한 ICV-STZ TE 집단에서는 발현량이 감소한 것으로 나타났다. Lipocalin-2의 발현량 역시 ICV-STZ CON 집단에서 증가하였지만 ICV-STZ TE 집단에서는 감소한 것으로 나타났다. 이와 유사한 연구로 조한샘 등(2012)은 파킨슨병을 유발시킨 설치류를 대상으로 트레드밀 운동을 실시한 결과 COX-2 양성 세포의 수가 감소하였다는 결과를 보고하였으며, Leem et al.(2011)의 연구결과에서도 TNF-α, IL-1β 그리고 COX-2가 트레드밀 운동을 통해 발현이 감소하였다고 보고하여 본 연구의 결과와 일치하는 것으로 나타났다.
신경세포 사멸은 많은 퇴행성 신경 질환의 주된 특성이며(Mattson, 2000), 설치류를 대상으로 COX-2, IL-1β 그리고 TNF-α를 과발현 되도록 유전자를 조작하면 행동과 기억에 손상이 유발되고 신경세포의 사멸이 증가된다고 보고 하였다(Andreasson et al., 2001; Song & Horrobin, 2004; Tobinick & Gross, 2008). Bax는 반응성 산소종이 과도하게 생성되면 발현이 증가되어 세포의 사멸을 유도하고 미토콘드리아에 존재하는 cytochrome C를 세포질로 방출하여 caspase-3의 활성을 통해 세포사멸을 일으키고 Bcl-2는 반대로 세포사멸을 억제하는 단백질로 Bax와 BCL-2의 발현 비율에 따라 세포의 생사가 결정된다고 알려져 있다(Fadeel et al., 1999; Krajewski et al., 1994; Srinivasula et al., 1998). 본 연구에서도 염증매개체와 염증성 사이토카인의 발현이 증가한 ICV-STZ CON 집단에서는 신경세포의 사멸이 증가한 것으로 나타났다. 신경세포의 사멸을 유도하는 caspase-3, bax의 발현이 증가하고 신경세포의 사멸을 억제하는 bcl-2의 발현은 감소한 것으로 나타났다. 하지만 트레드밀 운동을 실시한 ICV-STZ TE 집단에서는 신경세포의 사멸이 억제되는 것으로 나타났다. 마찬가지로 Bcl-2/Bax ratio도 ICV-STZ CON 집단에 비해 ICV-STZ TE 집단에서 증가한 것으로 나타나 트레드밀 운동을 통해 신경세포의 사멸이 억제된 것으로 나타났다.
결과적으로 트레드밀 운동이 ICV-STZ 처치로 유도된 뇌의 염증반응을 효과적으로 억제하여 염증매개체와 염증성 사이토카인의 발현이 감소되었으며 이를 통해 신경세포의 사멸도 억제된 것으로 생각된다. 따라서 이 연구의 결과를 통해 AD에서 발생하는 별아교세포의 활성화, 염증매개체와 염증성 사이토카인의 증가 그리고 신경세포의 사멸을 트레드밀 운동이 효과적으로 억제하고 이를 통해 학습과 기억능력이 개선되는 것으로 나타났다.
결론
이 연구는 ICV-STZ 처치로 유도된 알츠하이머 동물 모델 쥐를 대상으로 6주간의 트레드밀 운동이 별아교세포에서의 염증반응, 해마조직에서의 염증매개체, 염증성 사이토카인 그리고 신경세포의 사멸에 미치는 영향을 분석하였다. 트레드밀 운동은 ICV-STZ 실험동물의 인지능력을 개선시켰으며 뇌 해마부위에서 GFAP의 발현량을 감소시켰다. 또한 트레드밀 운동을 통해 뇌 해마부위에서 TNF-α, IL-1β, Lipocalin-2, COX-2와 같은 염증관련인자의 발현이 감소되었으며, caspase-3, Bax 발현의 감소, Bcl-2 발현의 증가를 통해 신경세포의 사멸을 감소시켰다. 이상의 결과를 요약하면 트레드밀 운동은 ICV-STZ 처치로 유도된 알츠하이머 동물 모델 쥐의 인지능력 저하, 염증반응 그리고 신경세포의 사멸을 억제하는 긍정적인 효과가 있는 것으로 나타났다.
Acknowledgements
이 논문은 2012년도 정부재원(교육과학기술부)으로 한국연구재단의 지원을 받아 연구되었음[NRF-2012-S1A5B5A02-023294].
References
이희혁, 윤진환, 정일규, 김승희, 김보균, 신말순, 고일규, 성윤희, 김창주(2009). 운동강도가 ICV STZ 투여로 유발된 기억력 손상흰쥐에서 해마 신경세포생성과 BDNF 발현에 미치는 영향. 운동과학, 18(4), 475-488.
이 희혁, 윤 진환, 정 일규, 김 승희, 김 보균, 신 말순, 고 일규, 성 윤희, 김 창주. 2009;운동강도가 ICV STZ 투여로 유발된 기억력 손상흰쥐에서 해마 신경세포생성과 BDNF 발현에 미치는 영향. 운동과학 18(4):475–488.조한샘, 신말순, 김창주, 백성수(2012). 트레드밀 운동이 6-OHDA로 유발된 파킨슨병 흰쥐 흑색질 내 염증지표에 미치는 영향. 운동과학, 21(1), 51-58.
조 한샘, 신 말순, 김 창주, 백 성수. 2012;트레드밀 운동이 6-OHDA로 유발된 파킨슨병 흰쥐 흑색질 내 염증지표에 미치는 영향. 운동과학 21(1):51–58.Al-Daghri, N., Bartlett, W. A., Jones, A. F., & Kumar, S. (2002). Role of leptin in glucose metabolism in type 2 diabetes. Diabetes Obes Metab, 4(3), 147-155.
Al-Daghri N., Bartlett W. A., Jones A. F., et al, Kumar S.. 2002;Role of leptin in glucose metabolism in type 2 diabetes. Diabetes Obes Metab 4(3):147–155. 10.1046/j.1463-1326.2002.00194.x.Andreasson, K. I., Savonenko, A., Vidensky, S., Goellner, J. J., Zhang, Y., Shaffer, A., Kaufmann, W. E., Worley, P. F., Isakson, P., & Markowska, A. L. (2001). Age-dependent cognitive deficits and neuronal apoptosis in cyclooxygenase-2 transgenic mice. J Neurosci, 21(20), 8198-8209.
. Andreasson K. I., Savonenko A., Vidensky S., Goellner J. J., Zhang Y., Shaffer A., Kaufmann W. E., Worley P. F., Isakson P., et al, Markowska A. L.. 2001;Age-dependent cognitive deficits and neuronal apoptosis in cyclooxygenase-2 transgenic mice. J Neurosci 21(20):8198–8209. 10.1523/jneurosci.21-20-08198.2001.Birks, J. (2006). Cholinesterase inhibitors for Alzheimer's disease. Cochrane Database Syst Rev(1), CD005593.
. Birks J.. 2006;Cholinesterase inhibitors for Alzheimer's disease. Cochrane Database Syst Rev (1)CD005593.Black, J. E., Isaacs, K. R., & Greenough, W. T. (1991). Usual vs. successful aging: some notes on experiential factors. Neurobiol Aging, 12(4), 325-328; discussion 352-325.
. Black J. E., Isaacs K. R., et al, Greenough W. T.. 1991;Usual vs. successful aging: some notes on experiential factors. Neurobiol Aging 12(4):325–328. discussion 352-325. 10.1016/0197-4580(91)90009-9.Choi, J., Lee, H. W., & Suk, K. (2011). Increased plasma levels of lipocalin 2 in mild cognitive impairment. J Neurol Sci, 305(1-2), 28-33.
. Choi J., Lee H. W., et al, Suk K.. 2011;Increased plasma levels of lipocalin 2 in mild cognitive impairment. J Neurol Sci 305(1-2):28–33. 10.1016/j.jns.2011.03.023.Cotman, C. W., & Berchtold, N. C. (2002). Exercise: a behavioral intervention to enhance brain health and plasticity. Trends Neurosci, 25(6), 295-301.
. Cotman C. W., et al, Berchtold N. C.. 2002;Exercise: a behavioral intervention to enhance brain health and plasticity. Trends Neurosci 25(6):295–301. 10.1016/s0166-2236(02)02143-4.Cuello, A. C., Ferretti, M. T., Leon, W. C., Iulita, M. F., Melis, T., Ducatenzeiler, A., Bruno, M. A., & Canneva, F. (2010). Early-stage inflammation and experimental therapy in transgenic models of the Alzheimer-like amyloid pathology. Neurodegener Dis, 7(1-3), 96-98.
. Cuello A. C., Ferretti M. T., Leon W. C., Iulita M. F., Melis T., Ducatenzeiler A., Bruno M. A., et al, Canneva F.. 2010;Early-stage inflammation and experimental therapy in transgenic models of the Alzheimer-like amyloid pathology. Neurodegener Dis 7(1-3):96–98. 10.1159/000285514.Dao, A. T., Zagaar, M. A., Levine, A. T., Salim, S., Eriksen, J. L., & Alkadhi, K. A. (2013). Treadmill exercise prevents learning and memory impairment in Alzheimer's disease-like pathology. Curr Alzheimer Res, 10(5), 507-515.
. Dao A. T., Zagaar M. A., Levine A. T., Salim S., Eriksen J. L., et al, Alkadhi K. A.. 2013;Treadmill exercise prevents learning and memory impairment in Alzheimer's disease-like pathology. Curr Alzheimer Res 10(5):507–515. 10.2174/1567205011310050006.Fadeel, B., Zhivotovsky, B., & Orrenius, S. (1999). All along the watchtower: on the regulation of apoptosis regulators. FASEB J, 13(13), 1647-1657.
. Fadeel B., Zhivotovsky B., et al, Orrenius S.. 1999;All along the watchtower: on the regulation of apoptosis regulators. FASEB J 13(13):1647–1657. 10.1096/fasebj.13.13.1647.Fuller, S., Steele, M., & Munch, G. (2010). Activated astroglia during chronic inflammation in Alzheimer's disease--do they neglect their neurosupportive roles?Mutat Res, 690(1-2), 40-49.
. Fuller S., Steele M., et al, Munch G.. 2010;Activated astroglia during chronic inflammation in Alzheimer's disease--do they neglect their neurosupportive roles? Mutat Res 690(1-2):40–49. 10.1016/j.mrfmmm.2009.08.016.Gomez-Pinilla, F., So, V., & Kesslak, J. P. (1998). Spatial learning and physical activity contribute to the induction of fibroblast growth factor: neural substrates for increased cognition associated with exercise. Neuroscience, 85(1), 53-61.
. Gomez-Pinilla F., So V., et al, Kesslak J. P.. 1998;Spatial learning and physical activity contribute to the induction of fibroblast growth factor: neural substrates for increased cognition associated with exercise. Neuroscience 85(1):53–61.Graham, S. H., & Hickey, R. W. (2003). Cyclooxygenases in central nervous system diseases: a special role for cyclooxygenase 2 in neuronal cell death. Arch Neurol, 60(4), 628-630.
. Graham S. H., et al, Hickey R. W.. 2003;Cyclooxygenases in central nervous system diseases: a special role for cyclooxygenase 2 in neuronal cell death. Arch Neurol 60(4):628–630.Grathwohl, S. A., Kalin, R. E., Bolmont, T., Prokop, S., Winkelmann, G., Kaeser, S. A., Odenthal, J., Radde, R., Eldh, T., Gandy, S., Aguzzi, A., Staufenbiel, M., Mathews, P. M., Wolburg, H., Heppner, F. L., & Jucker, M. (2009). Formation and maintenance of Alzheimer's disease beta-amyloid plaques in the absence of microglia. Nat Neurosci, 12(11), 1361-1363.
. Grathwohl S. A., Kalin R. E., Bolmont T., Prokop S., Winkelmann G., Kaeser S. A., Odenthal J., Radde R., Eldh T., Gandy S., Aguzzi A., Staufenbiel M., Mathews P. M., Wolburg H., Heppner F. L., et al, Jucker M.. 2009;Formation and maintenance of Alzheimer's disease beta-amyloid plaques in the absence of microglia. Nat Neurosci 12(11):1361–1363.Grutzendler, J., & Morris, J. C. (2001). Cholinesterase inhibitors for Alzheimer's disease. Drugs, 61(1), 41-52.
. Grutzendler J., et al, Morris J. C.. 2001;Cholinesterase inhibitors for Alzheimer's disease. Drugs 61(1):41–52. 10.2165/00003495-200161010-00005.Haass, C., & Selkoe, D. J. (2007). Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer's amyloid beta-peptide. Nat Rev Mol Cell Biol, 8(2), 101-112.
Haass C., et al, Selkoe D. J.. 2007;Soluble protein oligomers in neurodegeneration: lessons from the Alzheimer's amyloid beta-peptide. Nat Rev Mol Cell Biol 8(2):101–112.Hanzel, C. E., Pichet-Binette, A., Pimentel, L. S., Iulita, M. F., Allard, S., Ducatenzeiler, A., Do Carmo, S., & Cuello, A. C. (2014). Neuronal driven pre-plaque inflammation in a transgenic rat model of Alzheimer's disease. Neurobiol Aging, 35(10), 2249-2262.
. Hanzel C. E., Pichet-Binette A., Pimentel L. S., Iulita M. F., Allard S., Ducatenzeiler A., Do Carmo S., et al, Cuello A. C.. 2014;Neuronal driven pre-plaque inflammation in a transgenic rat model of Alzheimer's disease. Neurobiol Aging 35(10):2249–2262. 10.1016/j.neurobiolaging.2014.03.026.Hirst, W. D., Young, K. A., Newton, R., Allport, V. C., Marriott, D. R., & Wilkin, G. P. (1999). Expression of COX-2 by normal and reactive astrocytes in the adult rat central nervous system. Mol Cell Neurosci, 13(1), 57-68.
. Hirst W. D., Young K. A., Newton R., Allport V. C., Marriott D. R., et al, Wilkin G. P.. 1999;Expression of COX-2 by normal and reactive astrocytes in the adult rat central nervous system. Mol Cell Neurosci 13(1):57–68. 10.1006/mcne.1998.0731.Hoveida, R., Alaei, H., Oryan, S., Parivar, K., & Reisi, P. (2011). Treadmill running improves spatial memory in an animal model of Alzheimer's disease. Behav Brain Res, 216(1), 270-274.
. Hoveida R., Alaei H., Oryan S., Parivar K., et al, Reisi P.. 2011;Treadmill running improves spatial memory in an animal model of Alzheimer's disease. Behav Brain Res 216(1):270–274. 10.1016/j.bbr.2010.08.003.Jolkkonen, J., Gallagher, N. P., Zilles, K., & Sivenius, J. (2003). Behavioral deficits and recovery following transient focal cerebral ischemia in rats: glutamatergic and GABAergic receptor densities. Behav Brain Res, 138(2), 187-200.
. Jolkkonen J., Gallagher N. P., Zilles K., et al, Sivenius J.. 2003;Behavioral deficits and recovery following transient focal cerebral ischemia in rats: glutamatergic and GABAergic receptor densities. Behav Brain Res 138(2):187–200. 10.1016/s0166-4328(02)00241-3.Kalmijn, S., Launer, L. J., Stolk, R. P., de Jong, F. H., Pols, H. A., Hofman, A., Breteler, M. M., & Lamberts, S. W. (1998). A prospective study on cortisol, dehydroepiandrosterone sulfate, and cognitive function in the elderly. J Clin Endocrinol Metab, 83(10), 3487-3492.
. Kalmijn S., Launer L. J., Stolk R. P., de Jong F. H., Pols H. A., Hofman A., Breteler M. M., et al, Lamberts S. W.. 1998;A prospective study on cortisol, dehydroepiandrosterone sulfate, and cognitive function in the elderly. J Clin Endocrinol Metab 83(10):3487–3492. 10.1210/jc.83.10.3487.Kang, E. B., Kwon, I. S., Koo, J. H., Kim, E. J., Kim, C. H., Lee, J., Yang, C. H., Lee, Y. I., Cho, I. H., & Cho, J. Y. (2013). Treadmill exercise represses neuronal cell death and inflammation during Abeta-induced ER stress by regulating unfolded protein response in aged presenilin 2 mutant mice. Apoptosis, 18(11), 1332-1347.
. Kang E. B., Kwon I. S., Koo J. H., Kim E. J., Kim C. H., Lee J., Yang C. H., Lee Y. I., Cho I. H., et al, Cho J. Y.. 2013;Treadmill exercise represses neuronal cell death and inflammation during Abeta-induced ER stress by regulating unfolded protein response in aged presenilin 2 mutant mice. Apoptosis 18(11):1332–1347.Kim, H. B., Jang, M. H., Shin, M. C., Lim, B. V., Kim, Y. P., Kim, K. J., Kim, E. H., & Kim, C. J. (2003). Treadmill exercise increases cell proliferation in dentate gyrus of rats with streptozotocin-induced diabetes. J Diabetes Complications, 17(1), 29-33.
. Kim H. B., Jang M. H., Shin M. C., Lim B. V., Kim Y. P., Kim K. J., Kim E. H., et al, Kim C. J.. 2003;Treadmill exercise increases cell proliferation in dentate gyrus of rats with streptozotocin-induced diabetes. J Diabetes Complications 17(1):29–33. 10.1016/s1056-8727(02)00186-1.Krajewski, S., Krajewska, M., Shabaik, A., Miyashita, T., Wang, H. G., & Reed, J. C. (1994). Immunohistochemical determination of in vivo distribution of Bax, a dominant inhibitor of Bcl-2. Am J Pathol, 145(6), 1323-1336.
. Krajewski S., Krajewska M., Shabaik A., Miyashita T., Wang H. G., et al, Reed J. C.. 1994;Immunohistochemical determination of in vivo distribution of Bax, a dominant inhibitor of Bcl-2. Am J Pathol 145(6):1323–1336.Lee, S., Park, J. Y., Lee, W. H., Kim, H., Park, H. C., Mori, K., & Suk, K. (2009). Lipocalin-2 is an autocrine mediator of reactive astrocytosis. J Neurosci, 29(1), 234-249.
. Lee S., Park J. Y., Lee W. H., Kim H., Park H. C., Mori K., et al, Suk K.. 2009;Lipocalin-2 is an autocrine mediator of reactive astrocytosis. J Neurosci 29(1):234–249. 10.1523/jneurosci.5273-08.2009.Leem, Y. H., Lee, Y. I., Son, H. J., & Lee, S. H. (2011). Chronic exercise ameliorates the neuroinflammation in mice carrying NSE/htau23. Biochem Biophys Res Commun, 406(3), 359-365.
. Leem Y. H., Lee Y. I., Son H. J., et al, Lee S. H.. 2011;Chronic exercise ameliorates the neuroinflammation in mice carrying NSE/htau23. Biochem Biophys Res Commun 406(3):359–365. 10.1016/j.bbrc.2011.02.046.Mattson, M. P. (2000). Apoptosis in neurodegenerative disorders. Nat Rev Mol Cell Biol, 1(2), 120-129.
. Mattson M. P.. 2000;Apoptosis in neurodegenerative disorders. Nat Rev Mol Cell Biol 1(2):120–129. 10.1038/35040009.McGeer, P. L., & McGeer, E. G. (2002). Inflammatory processes in amyotrophic lateral sclerosis. Muscle Nerve, 26(4), 459-470.
. McGeer P. L., et al, McGeer E. G.. 2002;Inflammatory processes in amyotrophic lateral sclerosis. Muscle Nerve 26(4):459–470. 10.1002/mus.10191.Milner, B., Squire, L. R., & Kandel, E. R. (1998). Cognitive neuroscience and the study of memory. Neuron, 20(3), 445-468.
. Milner B., Squire L. R., et al, Kandel E. R.. 1998;Cognitive neuroscience and the study of memory. Neuron 20(3):445–468.Niu, Y. L., Zhang, W. J., Wu, P., Liu, B., Sun, G. T., Yu, D. M., & Deng, J. B. (2010). Expression of the apoptosis-related proteins caspase-3 and NF-kappaB in the hippocampus of Tg2576 mice. Neurosci Bull, 26(1), 37-46.
. Niu Y. L., Zhang W. J., Wu P., Liu B., Sun G. T., Yu D. M., et al, Deng J. B.. 2010;Expression of the apoptosis-related proteins caspase-3 and NF-kappaB in the hippocampus of Tg2576 mice. Neurosci Bull 26(1):37–46.Popovic, M., Caballero-Bleda, M., Puelles, L., & Popovic, N. (1998). Importance of immunological and inflammatory processes in the pathogenesis and therapy of Alzheimer's disease. Int J Neurosci, 95(3-4), 203-236.
. Popovic M., Caballero-Bleda M., Puelles L., et al, Popovic N.. 1998;Importance of immunological and inflammatory processes in the pathogenesis and therapy of Alzheimer's disease. Int J Neurosci 95(3-4):203–236.Puli, L., Pomeshchik, Y., Olas, K., Malm, T., Koistinaho, J., & Tanila, H. (2012). Effects of human intravenous immunoglobulin on amyloid pathology and neuroinflammation in a mouse model of Alzheimer's disease. J Neuroinflammation, 9, 105.
. Puli L., Pomeshchik Y., Olas K., Malm T., Koistinaho J., et al, Tanila H.. 2012;Effects of human intravenous immunoglobulin on amyloid pathology and neuroinflammation in a mouse model of Alzheimer's disease. J Neuroinflammation 9105. 10.1186/1742-2094-9-105.Rohn, T. T. (2010). The role of caspases in Alzheimer's disease; potential novel therapeutic opportunities. Apoptosis, 15(11), 1403-1409.
. Rohn T. T.. 2010;The role of caspases in Alzheimer's disease; potential novel therapeutic opportunities. Apoptosis 15(11):1403–1409. 10.1007/s10495-010-0463-2.Rubio-Perez, J. M., & Morillas-Ruiz, J. M. (2012). A review: inflammatory process in Alzheimer's disease, role of cytokines. ScientificWorldJournal, 2012, 756357.
Rubio-Perez J. M., et al, Morillas-Ruiz J. M.. 2012;A review: inflammatory process in Alzheimer's disease, role of cytokines. ScientificWorldJournal 201210.1100/2012/756357.Song, C., & Horrobin, D. (2004). Omega-3 fatty acid ethyl-eicosapentaenoate, but not soybean oil, attenuates memory impairment induced by central IL-1beta administration. J Lipid Res, 45(6), 1112-1121.
. Song C., et al, Horrobin D.. 2004;Omega-3 fatty acid ethyl-eicosapentaenoate, but not soybean oil, attenuates memory impairment induced by central IL-1beta administration. J Lipid Res 45(6):1112–1121.Srinivasula, S. M., Ahmad, M., Fernandes-Alnemri, T., & Alnemri, E. S. (1998). Autoactivation of procaspase-9 by Apaf-1-mediated oligomerization. Mol Cell, 1(7), 949-957.
. Srinivasula S. M., Ahmad M., Fernandes-Alnemri T., et al, Alnemri E. S.. 1998;Autoactivation of procaspase-9 by Apaf-1-mediated oligomerization. Mol Cell 1(7):949–957. 10.1016/s1097-2765(00)80095-7.Tobinick, E. L., & Gross, H. (2008). Rapid cognitive improvement in Alzheimer's disease following perispinal etanercept administration. J Neuroinflammation, 5, 2.
. Tobinick E. L., et al, Gross H.. 2008;Rapid cognitive improvement in Alzheimer's disease following perispinal etanercept administration. J Neuroinflammation 52. 10.1186/1742-2094-5-2.Trejo, J. L., Carro, E., & Torres-Aleman, I. (2001). Circulating insulin-like growth factor I mediates exercise-induced increases in the number of new neurons in the adult hippocampus. J Neurosci, 21(5), 1628-1634.
. Trejo J. L., Carro E., et al, Torres-Aleman I.. 2001;Circulating insulin-like growth factor I mediates exercise-induced increases in the number of new neurons in the adult hippocampus. J Neurosci 21(5):1628–1634. 10.1523/jneurosci.21-05-01628.2001.van Praag, H., Kempermann, G., & Gage, F. H. (1999). Running increases cell proliferation and neurogenesis in the adult mouse dentate gyrus. Nat Neurosci, 2(3), 266-270.
. van Praag H., Kempermann G., et al, Gage F. H.. 1999;Running increases cell proliferation and neurogenesis in the adult mouse dentate gyrus. Nat Neurosci 2(3):266–270. 10.1038/6368.Wang, X., Chen, S., Ma, G., Ye, M., & Lu, G. (2005). Involvement of proinflammatory factors, apoptosis, caspase-3 activation and Ca2+ disturbance in microglia activation-mediated dopaminergic cell degeneration. Mech Ageing Dev, 126(12), 1241-1254.
. Wang X., Chen S., Ma G., Ye M., et al, Lu G.. 2005;Involvement of proinflammatory factors, apoptosis, caspase-3 activation and Ca2+ disturbance in microglia activation-mediated dopaminergic cell degeneration. Mech Ageing Dev 126(12):1241–1254. 10.1016/j.mad.2005.06.012.White, R. E., McTigue, D. M., & Jakeman, L. B. (2010). Regional heterogeneity in astrocyte responses following contusive spinal cord injury in mice. J Comp Neurol, 518(8), 1370-1390.
. White R. E., McTigue D. M., et al, Jakeman L. B.. 2010;Regional heterogeneity in astrocyte responses following contusive spinal cord injury in mice. J Comp Neurol 518(8):1370–1390.Wood, J. A., Wood, P. L., Ryan, R., Graff-Radford, N. R., Pilapil, C., Robitaille, Y., & Quirion, R. (1993). Cytokine indices in Alzheimer's temporal cortex: no changes in mature IL-1 beta or IL-1RA but increases in the associated acute phase proteins IL-6, alpha 2-macroglobulin and C-reactive protein. Brain Res, 629(2), 245-252.
. Wood J. A., Wood P. L., Ryan R., Graff-Radford N. R., Pilapil C., Robitaille Y., et al, Quirion R.. 1993;Cytokine indices in Alzheimer's temporal cortex: no changes in mature IL-1 beta or IL-1RA but increases in the associated acute phase proteins IL-6, alpha 2-macroglobulin and C-reactive protein. Brain Res 629(2):245–252.Yoshiyama, Y., Higuchi, M., Zhang, B., Huang, S. M., Iwata, N., Saido, T. C., Maeda, J., Suhara, T., Trojanowski, J. Q., & Lee, V. M. (2007). Synapse loss and microglial activation precede tangles in a P301S tauopathy mouse model. Neuron, 53(3), 337-351.
. Yoshiyama Y., Higuchi M., Zhang B., Huang S. M., Iwata N., Saido T. C., Maeda J., Suhara T., Trojanowski J. Q., et al, Lee V. M.. 2007;Synapse loss and microglial activation precede tangles in a P301S tauopathy mouse model. Neuron 53(3):337–351. 10.1016/j.neuron.2007.01.010.