12주간 복합운동이 난소절제 쥐 골밀도, 골대사 지표 및 OPG/RANKL mRNA 발현에 미치는 영향
Park, Se Hwan1; Kim, Ze One2; Ji, Yong Seok3; Yoon, Jin Hwan1*
체육과학연구Korean Journal of Sport Science, Vol.30, No.3, pp.449-458
https://doi.org/10.24985/kjss.2019.30.3.449
© Korea Institute of Sport Science
Abstract
Purpose
Osteoporosis is a systemic metabolic bone disease characterized by gradual decrease of bone mass and damage of the bone microstructure. In particular, postmenopausal osteoporosis is the most common type in women after menopause. This study aims to investigate the effects of combined exercise training on bone mineral density (BMD) and OPG/RANKL mRNA levels in ovariectomized rats.
Methods
A total of 40 Sprague-Dawley female rats were randomly divided into four groups: (1) CON (sham-operation, n=10), (2) OVX (ovariectomy, n=10), (3) OVX-REX (ovariectomy-resistance exercise, n=10), and (4) OVX-ARE (ovariectomy-combined aerobic and resistance exercise, n=10). Combined exercise training was performed on a treadmill and ladder adapted to rats in alternate days (4 days/wk, for 12 wk).
Results
Compared to the OVX group, all exercise treatments increased BMD and bone breaking force(p<0.05). In the bone turnover markers, serum C-terminal telopeptides of type-1 collagen (CTX-1) was significantly decreased in the exercise groups compared with OVX group and osteocalcin (OC) level was increased in the exercise groups (p<0.05). Additionally, in the exercise groups, expression of OPG mRNA was significantly increased compared with OVX group (p<0.05), and RANKL mRNA was slightly decreased but no significant between groups. Furthermore, OVX-ARE group showed more effects than OVX-REX group.
초록
목적
골다공증은 점진적인 골량 감소 및 골 미세구조의 손상으로 특징되는 대사성 골 질환이다. 특히, 폐경기성 골다공증은 폐경 후 중년 여성에게서 흔히 발생된다. 이 연구의 목적은 난소절제 쥐를 대상으로 12주간의 복합운동이 골밀도, 골대사 지표 및 OPG/RANKL mRNA 발현에 미치는 영향을 규명하고자 하였다.
방법
총 40마리 SD계열 암컷 쥐를 통제군(CON, n=10), 난소절제군(OVX, n=10), 난소절제-저항성 운동군(OVX-REX, n=10), 난소절제-복합운동군(OVX-ARE, n=10)으로 무선배정 하였다. 복합운동은 트레드밀 운동과 사다리 등반 운동을 격일제로 12주 동안 주 4회 실시하였다.
결과
난소절제군과 비교하여 모든 운동 처치군의 골밀도 및 골강도는 유의하게 높은 것으로 나타났다(p<0.05). 골 대사 지표에서, 혈청 CTX-1 농도는 난소절제군과 비교하여 모든 운동 처치군에서 유의한 감소(p<0.05)가 나타났으며, 혈청 osteocalcin 농도는 유의하게 증가하였다(p<0.05). 추가적으로 OPG mRNA 발현은 운동 처치군이 난소절제군과 비교하여 유의한 증가를 나타내었고, 반면, RANKL mRNA 발현 수준은 감소하는 경향을 보였으나, 그룹 간 유의한 차이는 없었다. 특히, 복합운동군이 단일 형태의 저항성 운동군과 비교하여 모든 측정 변인에서 더 긍정적인 효과를 나타내었다.
서 론
폐경기 여성은 호르몬 불균형, 칼슘 결핍 및 체내 산화 스트레스 증가로 인해 비만, 관상동맥 질환, 알츠하이머, 골다공증 등과 같은 다양한 질병에 노출된다(Albertazzi, 2007; Imtiaz et al., 2017). 특히, 폐경 여성에게서 발생하는 골다공증은 에스트로겐 결핍에 유도되는 점진적인 골밀도 감소와 뼈 미세 구조의 악화 및 골절 위험 증가로 특징되는 대사성 골 질환이다(Farr et al., 2019; Han et al., 2019).
정상적인 상태에서 뼈 구조는 파골 세포(osteoclast)에 의한 골 흡수와 조골 세포(osteoblast)에 의한 골 형성의 반복적인 remodeling 과정을 거치게 되고, 이는 건강한 뼈 유지와 각종 면역세포의 발달 및 성숙에 중요한 골수 구조를 형성한다(Walsh et al., 2006). 따라서 이들 두 세포의 생리적·기능적 상호 균형은 건강한 골격계 형성에 필수적이다(Wang et al., 2014).
반면, 에스트로겐 감소 및 결핍은 조골세포와 파골세포 항상성에 부정적 영향을 미칠 수 있으며, 이로 인해 골 형성 감소 및 골 흡수 증가에 따른 단위용적 내 골량(bone mass)이 감소하게 된다(Lobersztajn & Tremollieres, 2012; van Geel et al., 2009). 이와 관련된 선행연구에서, 뼈 건강(bone health)의 주요 지표인 골밀도(bone mineral density, BMD)는 폐경 발생 후 5년 동안 평균적으로 약 3.1% 감소되는 것으로 보고되고 있는데, 폐경 이후 15년간 총 골밀도 손실이 7.9% 가량임(Zidon et al., 2018)을 감안할 때, 폐경 초기 단계에서부터 골밀도 감소 예방을 위한 다양한 치료적 전략이 요구됨을 유추할 수 있다.
폐경기성 골다공증의 발생은 파골세포의 분화와 직접적으로 연관되며(Beederman et al., 2014), 파골세포 분화는 receptor activator of NF-κB (RANK)/receptor activator of NF-κB ligand (RANKL) 신호체계에 매개된다(Kim et al., 2014). 특히, RANKL는 파골전구세포와 파골세포에 발현되는 수용체인 RANK를 자극함으로써 파골전구세포의 분화를 촉진하고 또한 세포사멸(apoptosis)을 억제한다. 한편, osteoprotegerin (OPG)는 RANK/RANKL의 결합을 방해하고 RANKL과 결합함으로써 골 흡수 억제를 통해 파골세포의 세포사멸을 촉진시킨다(Tanaka et al., 2011). 선행연구에서, 폐경기성 골다공증과 류마티스 관절염 환자의 경우 RANKL 발현이 증가(Eghbali-Fatourechi et al., 2003)되는 것으로 나타나, RANKL을 표적(target)으로 한 다양한 중재 전략은 파골세포와 관련된 질환의 예방과 개선을 위한 중요한 과제라 할 수 있다.
이와 더불어, osteocalcin (OC), C-terminal telopeptide of collagen type 1 (CTx-1) 등은 골 대사(bone metabolism)에 관여하는 주요 요인으로 제안된다. OC는 조골세포(osteoblast)로 부터 합성되는데 폐경기 및 청소년기와 같이 골전환(bone turnover)이 증가된 시기에 높은 수준을 보이는 것으로 알려진 반면에(Lee et al., 2005), CTx는 뼈의 손상이 있을 때 혈중으로 유리되어 나오는 콜라겐 물질로서 골흡수 상태를 예측하는데 중요한 인자이다 (Srividhya et al., 2015).
흔히 폐경과 관련된 대사적 변화에 대한 호르몬 치료 요법이 널리 이용되고 있으며, 그 효과성 역시 선행연구를 통해 입증되고 있다. 하지만, 이러한 약리적 요법의 효과성에도 불구하고 Albertazzi(2007) 및 Sprague et al.(2012)은 장기간의 호르몬 대체요법이 자궁내막 암, 유방암, 난소암 및 심혈관 질환 등과 같은 심각한 부작용을 초래함을 보고하였다.
반면, 신체활동은 골다공증 관리를 위한 비약리적 접근으로써, 뼈 건강 유지를 위한 중요한 매개체로 제안된다. 폐경기 중년 여성의 골밀도 및 골 대사 관련 인자의 조절장애(dysregulation)에 대한 규칙적인 운동 및 과거 지속적인 운동 참여 경험의 긍정적 효과는 여러 선행연구를 통해 입증되었다(Andreoli et al., 2012; Beck et al., 2011; Gómez-Cabello et al., 2012; Muir et al., 2013). 운동이 골 소실 방지를 통한 골밀도 개선에 효과적인 전략으로써 널리 이용됨에도 불구하고, 일부 선행연구에서는 운동 유형 및 강도에 따른 상충된 결과를 제시하고 있다. Rector et al.(2009)은 운동의 형태에 따라 골밀도에 미치는 영향에 차이가 있음을 보고하였는데, 저항성 운동선수와 달리기 선수는 사이클 선수보다 골밀도가 높고 저항성 운동선수보다는 달리기 선수가 골밀도가 높다는 결과에 따라 달리기 선수가 운동 특성상 높은 충격을 가장 많이 받는 것으로 보고하였다. 또한, 국내의 연구에서 Jung et al.(2007)은 난소절제 쥐를 대상으로 12주 동안 전신진동 운동을 시킨 결과 대퇴골 세포에서 OPG 단백질 발현이 유의하게 증가하였고 RANKL 발현은 감소하였지만 유의한 차이가 없었다고 보고하였다. 이러한 결과는 운동의 종류, 운동강도, 운동기간의 차이에 기인하는 것으로 생각된다.
따라서 본 연구에서는 단일 형태의 운동과 비교하여 12주간의 규칙적인 복합운동 중재가 폐경모델 난소 절제 쥐의 골밀도, 골대사 지표 및 OPG 및 RANKL mRNA 발현에 미치는 영향을 관찰하고자 하였다.
연구 방법
1) 실험동물 및 식이방법
실험동물은 Nara Biotech.(Seoul, Korea)에서 공급받은 Sprague-Dawley (SD) 계열 20주령 암컷 흰쥐 40마리를 대상으로 하였다. 실험동물은 사육케이지(42 × 28 cm)를 이용해 실험실 온도 22~24℃, 습도 60±5%가 유지되며, 밤낮주기(12시간 light/ 12시간 dark)가 자동 조절 장치에 의해 조절되는 사육실에서 1주간 예비 사육 후 난소 절제 시술을 시행하여 대조군(CON, n=10), 난소절제 대조군(OVX, n=10), 난소절제군-저항성 운동군(OVX-REX, n=10), 난소절제군-복합운동군(OVX-ARE, n=10)으로 나누어 12주간 실험을 실시하였다. 식이는 실험기간 동안 고형사료(단백질 22.5%, 지방 3.5%, 저섬유 7.5%, 회분 9.0%, 칼슘 0.7%, 인 0.5%)와 물을 충분히 섭취하도록 하였으며, 동물실험 윤리위원회의 승인(HNU 2018-1)을 받아 실험을 수행하였다.
2) 난소절제술
난소절제 시술은 Idris(2012)의 선행연구를 토대로 실시하였다. Ketamine (Korea 100 mg/kg)과 2% Xylazine (Rumpun 0.15 mL/kg)으로 전신 마취하고 제모 및 시술전 무균 처리(10% povidone-iodine scrub followed by 70% alcohol wipe)를 시행하였다. 실험동물의 복측 중앙에 1cm 가량의 절개를 시행한 후 봉합용 실로 난소를 결찰하고 난소절제를 양측으로 시행하였다. 난소절제 후 각 장기를 복강 내로 재위치 시킨 후 봉합용 실로 층별 봉합을 하고 감염 방지를 위해 항생제(cafazo-lin 50 mg/kg)를 근육에 주사하였다. 시술 1주일 후 회복 과정을 거쳐 정상 회복된 쥐에 한하여 실험을 실시하였다.
3) 운동 프로토콜
복합운동 프로그램은 Rodrigues et al.(2007)과 de Almeida et al.(2013)의 방법을 참고하여 1일 45분, 14-16m/min (최대산소섭취량의 65-70%)의 강도로 설정된 유산소 운동과 Kido et al.(2018)의 연구를 토대로 한 저항성 운동을 총 12주간 각각 1회씩 격일로 실시하였다. 저항성 운동은 길이 135cm, 간격 2.5cm의 철제 사다리를 80도의 경사로 설치하고 꼬리에 점진적인 무게 부하를 주어 경사도를 오르는 운동을 1일 8회, 주 2회의 빈도로 총 12주간 실시하였다. 모든 운동그룹은 본 운동에 앞서 1주일간의 적응기간을 적용하였다.
4) 대퇴골 골밀도 및 골강도 측정
12주간의 실험 종료 후 적출한 대퇴골은 골격에 붙어있는 근육, 인대 및 지방을 제거하고 50℃에서 건조한 후 골밀도 및 골미네랄 함량을 방사선 골밀도 측정기(pDEXA X-ray bone densitometer, Norland Co., USA)를 사용하여 측정하였다. 해상도는 1.0×1.0 mm, 스피드는 20 mm/sec, 샘플의 길이는 1.60cm, 폭(너비)은 3.90cm로 설정하여 측정하였다. 골강도(breaking force)는 대퇴골에 하중이 걸렸을 때 부러지는 순간의 최대응력을 의미하며, 종합물성측정기(Rheo Meter CR-500DX, SUN SCIENTIFIC Co. Ltd., Japan)를 사용하여 측정하였다. 측정항목은 구부림 강도 측정, 진입 깊이는 5.0 mm, 인장/압축은 압축, 테이블(헤드)스피드는 60 mm/min, 로드셀 최대 응력은 10 kg, 샘플의 어댑터 거리는 0.0 mm, 아답터와 지지대의 간격은 10 mm로 설정하며, 샘플 타입은 원통형(눕힘), 길이와 높이 설정은 각 샘플의 해당되는 mm를 설정 조건으로 하여 측정하였다.
5) 혈청 골대사 지표
혈액 채취는 12주간 운동 중재 후 실험동물을 희생시키고, 심장으로부터 5ml의 혈액을 채혈하였다. 혈청 OC 측정은 one-step solid phase를 이용한 competitive radioimmun-assay에 기초한 Osteocalcin MYRIA kit (Technogenetics Srl, Milan, Italy)으로 radioimmunoassay를 한 후, gamma-counter를 이용하여 항원 항체 결합 정도를 측정하였다. 혈청 CTx-1 농도 측정은 Rat LapsTM (CTX-1) EIA kit (Immunodiagnostic Systems Ltd., Gaithersburg, MD, USA)을 사용하여 측정하였다.
6) RANKL 및 OPG mRNA 발현
(1) Total RNA 추출
Total RNA의 추출은 대퇴골에서 적출한 조직에 Trizol 500μl를 첨가한 후 syringe를 이용하여 세포를 균질화시키고 15~30℃에서 5분간 방치한 후 chloroform 100 μl을 첨가하여 부드럽게 inverted mix 한 후, 4℃에서 12000g로 15분간 원심분리한 후 상층액을 획득하였다. 상층액을 새 tube에 옮기고 동량의 isopropanol과 혼합하여 실온에서 10분간 침전시킨 후 12000g로 10분간 원심분리 하여 RNA pellet을 얻은 후 여기에 75% ethanol 500μl를 넣어 7500g로 5분간 원심분리한 후 상층액을 제거하고 상온에서 방치하여 RNA pellet을 완전히 건조시킨 후 Diethylpyrocarbonate (DECP) 용액으로 RNA pellet을 녹인다. 녹인 RNA는 분광광도계인 DU 530(Beckman instrument, CA, USA)를 이용하여 260nm에서 정량하였다.
(2) 역전사-중합효소 연쇄반응
역전사(reverse transcription) 반응은 준비된 total RNA 2 μg을 DNase I(10 U/μl) 2 U/tube를 37℃ heating block에서 30분간 반응한 후 75℃에서 10분 동안 변성시키고, 이에 2.5 μl 10 mM dNTPs mix, 1 μl random sequence hexanucleotides (25 pmole/ 25 μl), RNA inhibitor로써 1 μl RNase inhibitor (20 U/μl), 1 μl 100 mM DTT, 4.5 μl 5×RT buffer (250 mM Tris-HCL, pH 8.3, 375 mM KCL, 15 mM MgCL2)를 가한 후, 1 μl의 M-MLV RT (moloney murine leukemia virus reverse transcriptase, Promega, U.S.A.)에 200 U/μl를 다시 가하고 DEPC 처리된 증류수로서 최종부피가 20 μl가 되도록 하였다. 이 20 μl의 반응 혼합액을 잘 섞은 뒤 2,000 rpm에서 5초간 원심 침강하여 37 ℃ heating block에서 60분 동안 반응시켜 first-strand cDNA를 합성한 다음, 95℃에서 5분 동안 방치하고 M-MLV RT를 불활성화 시킨 후 cDNA를 합성하였다.
(3) Quantitative real time RT-PCR
RT-PCR은 7500 Real-time PCR system을 이용하였다. OPG mRNA의 primer는 Forward: 5'-TGTGGAATAGATGTCACCCTGTGC-3’; Reverse: 5'-CACAGAGGTCAATGTCTTGGATGATC-3'이며, RANKL mRNA primer는 Forward: 5'-GCTTCTCAGGAGTTCCAGCTATGAT-3'; Reverse:5'-CGTTGCTTAACGTCATGTTAGAGATCT-3'을 이용하였으며, GAPAD의 primer는 Forward: 5'-CAAGGTCATCCATGACAACTTTG3';Reverse: 5'-GTCCACCACCCTGTTGCTGTAG-3'를 이용하였다. 반응 조건은 pre-denaturation은 2min at 50℃, 10min 94℃, 그리고 40 cycles을 0.15min at 95℃, 1min at 45℃에서 수행하였다.
연구 결과
1) 대퇴골 골밀도 및 골강도
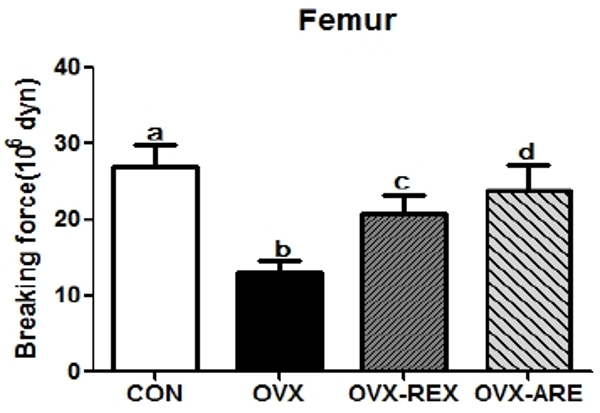
12주간의 복합운동 중재 후 대퇴골의 골밀도와 골강도는 <Fig. 1, 2>와 같다. 골밀도는 모든 집단 간 유의한 차이가 나타났으며(p<0.05), OVX 그룹은 모든 그룹과 비교하여 낮은 골밀도를 나타내었다. OVX-ARE 그룹은 OVX 그룹과 비교하여 높은 골밀도를 보였으나, OVX-REX 그룹과는 유의한 차이는 나타나지 않았다. 골절을 예측할 수 있는 골강도 또한 모든 집단 간 유의한 차이가 나타났다(p<0.01). OVX-REX와 OVX-ARE 그룹은 OVX 그룹과 비교하여 유의하게 증가되었으며, OVX-ARE 그룹이 OVX-REX 그룹보다 높은 수치를 나타내었다.
Fig. 1.
CON: control group, OVX: ovariectomized group, OVX-REX: ovariectomized and resistance exercise group, OVX-ARE: ovariectomized-combined aerobic and resistance exercise group. BMD: bone mineral density. All data presented as the Mean ± SD. a,b,c,d Different letters indicate a significant difference between groups (p<0.05)
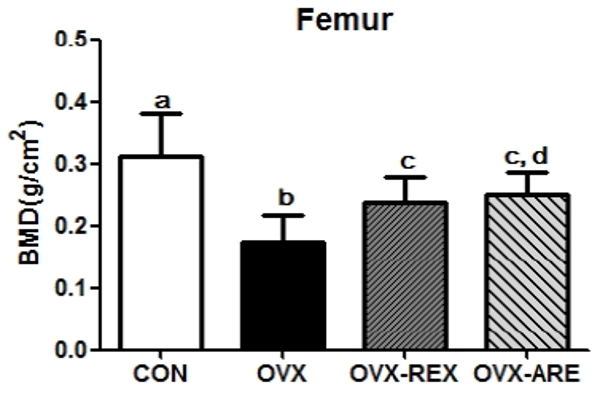
Fig. 2.
CON: control group, OVX: ovariectomized group, OVX-REX: ovariectomized and resistance exercise group, OVX-ARE: ovariectomized-combined aerobic and resistance exercise group. All data are presented as the Mean ± SD. a,b,c,d Different letters indicate a significant difference between groups (p<0.05)
2) 혈청 골 대사관련 인자; Osteocalcin, CTx-1
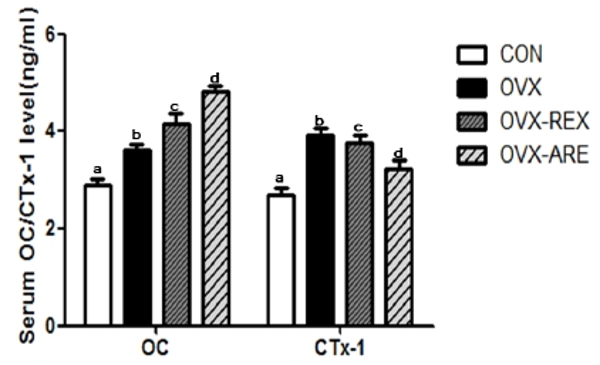
12주간의 복합운동 중재 후 혈청 골대사 인자의 농도는 <Fig. 3>과 같다. 혈청 OC 농도는 집단 간 유의한 차이를 보였으며(p<0.05), 운동 그룹이 OVX 그룹에 비해 높은 농도를 나타내었다. 운동 형태에 따른 혈청 OC 농도는 OVX-ARE 그룹이 OVX-REX 그룹 보다 유의하게 더 높은 것으로 나타났다. 골 흡수 관련 인자는 CTx-1의 혈청 농도는 집단 간 유의한 차이를 보였으며, OVX 그룹에서 가장 높게 나타났으며, 운동 처치그룹은 OVX 그룹에 비하여 낮은 농도를 나타내었다. 또한 OVX-ARE 그룹이 OVX-REX 그룹보다 더 낮은 농도를 나타내었다.
Fig. 3.
CON: control group, OVX: ovariectomized group, OVX-REX: ovariectomized-combined aerobic and resistance exercise group. OC: osteocalcin, CTx-1: c-terminal telopeptide of collagen type 1. All data presented as the Mean ± SD.a,b,c,d Different letters indicate a significant difference between groups (p<0.05)
3) RANKL 및 OPG mRNA 발현
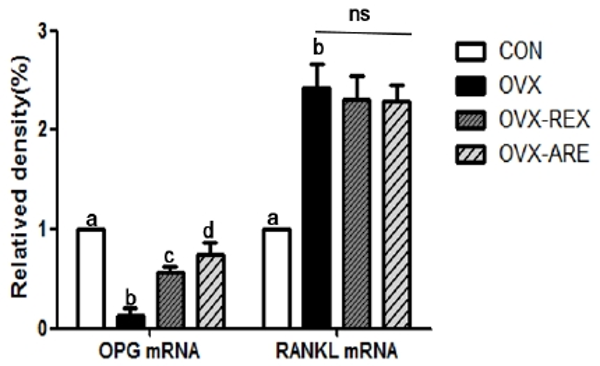
12주간의 복합운동 중재 후 OPG mRNA와 RANKL mRNA 발현을 분석한 결과는 <Fig. 4>와 같다. OPG mRNA 발현은 집단 간 유의한 차이가 나타났으며(p<0.05), OVX 그룹의 발현량이 가장 낮게 나타났다. 운동 처치는 OPG mRNA 발현을 유의하게 증가시켰으며, 특히 OVX-ARE 그룹이 OVX-REX 그룹에 비해 더 높은 발현량을 보였다. 반면, RANKL mRNA 발현은 OVX 그룹이 CON 그룹에 비하여 유의하게 증가되었으나, 운동 처치에 따른 유의한 차이는 나타나지 않았다.
Fig. 4.
CON: control group, OVX: ovariectomized group, OVX-REX: ovariectomized-combined aerobic and resistance exercise group. OPG: osteoprotegerin, RANKL: receptor activator of NF-kB ligand. All data presented as the Mean ± SD. a,b,c,d Different letters indicate a significant difference between groups (p<0.05). ns: not significant.
논의
에스트로겐 결핍에 따른 골 대사 항상성의 불균형은 골다공증 발생과 직접적으로 연관된다. 특히 골 대사 항상성의 장애로 발생되는 단위 면적 내 골량 감소는 미세한 충격에도 불구하고 쉽게 골절을 일으킬 수 있다. 일반적으로 난소절제술을 시행한 동물 모델은 골량 및 골강도가 낮을 뿐만 아니라 골대사의 전환이 더 빠르게 나타나며, 이러한 현상은 골다공증으로 고통받는 중년 여성들에서도 관찰된다(Katsumata et al., 1995).
본 연구에서는 폐경기성 골다공증 발생과 관련된 주요 요인에 대한 복합운동의 중재 효과를 규명하고자 하였다. 본 연구결과에서, 난소절제를 시행한 OVX 그룹은 대퇴골 골밀도, 골강도 및 혈청 OC 농도가 유의하게 감소된 반면 골 흡수 지표 CTx-1 농도는 유의하게 증가하였다. 또한, 골수 세포 내 OPG mRNA 발현이 유의하게 감소되었고, RANKL mRNA 발현은 증가되었다. 이와는 반대로 12주간의 규칙적인 운동 중재는 RANKL을 제외한 나머지 변인들의 개선에 긍정적인 영향을 미치는 것을 확인할 수 있었다.
운동 중 발생되는 기계적 힘(mechanical force)은 지면반력과 근 수축력 활성을 통해 골 조직의 전반적인 건강에 기여할 수 있다(Moreira et al., 2014). 특히, 골밀도에 대한 운동의 효과를 분석한 선행연구에서, Zhao et al.(2017)은 장기간의 복합운동이 60세 이상 폐경기 중년 여성의 요추, 대퇴경부, 엉덩이 및 전신 골밀도를 유지시키는데 효율적인 전략임을 제안하였고, Bolton et al.(2012)은 폐경기 여성을 대상으로 52주간 1일 60분, 주 3회로 구성된 저항성운동과 유산소 운동의 복합처치가 엉덩이 관절(hip joint) 골밀도 증가에 유의한 영향을 미칠 수 있다고 하였다. 또한 동물 실험에서, Oh et al.(2016)은 난소절제 흰쥐를 대상으로 8주간 고강도 수영 운동을 시킨 결과 골밀도와 골강도가 유의하게 증가됨을 확인하였으며, Tromp et al.(2006)은 난소절제술 모델에서 기계적 부하가 동반된 운동 중재는 골밀도와 골 무기질 함량에 긍정적 영향을 미친다고 하였다. 이러한 결과는 본 연구에서 복합운동 중재를 통해 관찰된 대퇴골 골밀도와 골강도의 유의한 개선과 일치된다.
또한, 골다공증의 진행 및 병적 상태에서 골 형성 및 골 흡수 중 혈액으로 방출되는 OC 및 CTx-1의 농도 수준은 조골세포와 파골세포의 활성을 예측할 수 있는 주요 지표이다. Tartibian et al.(2011)의 연구에서 12주간 적정 강도의 유산소 운동 중재는 폐경 여성의 혈중 OC 농도 증가에 긍정적 영향을 미칠 수 있음이 보고되었고, Iwamoto et al.(2004)은 난소절제술을 시행한 설치류 모델에서 고강도의 유산소 운동은 혈중 OC 농도를 유의하게 증가시키는 것으로 보고하였다. 반면, 골 흡수의 상태를 반영하는 혈중 CTx-1 농도에 관한 선행연구에서, Wieczorek-Baranowska et al.(2012)와 Kitareewan et al.(2011)은 폐경기 여성을 대상으로 실시한 유산소성 운동프로그램 중재는 혈중 CTx-1 농도에 유의한 감소를 가져올 수 있음을 보고하였다. 이러한 선행 연구 결과는 본 연구에서 나타난, 혈청 OC 농도 증가 및 CTx-1 농도 감소와 일치되는 결과이다. 따라서 난소절제에 따른 에스트로겐 감소로 유도된 조골세포의 활성 억제 및 파골세포 활성 증가는 규칙적인 운동 중재를 통해 개선될 수 있으며, 특히 단일 형태의 저항성 운동보다 복합운동이 더 긍정적 효과를 나타낼 수 있음을 제안하는 결과라 생각된다.
골 대사의 항상성은 조골세포 골 형성과 파골세포 골 흡수 사이의 균형에 의해 유지되며, 또한 OPG와 RANKL의 상대적 수준은 osteogenesis와 osteoclastogenesis 과정을 결정한다(Bundkirchen et al., 2018). OPG와 RANKL의 기능 저하 및 신호전달 경로의 이상조절은 골다공증을 포함한 골량 감소와 밀접한 관련이 있다(Kim et al., 2017). 이와 관련된 선행연구에서, Wang et al.(2013)은 난소절제 모델에서 규칙적인 유산소 운동이 OPG mRNA 발현을 유의하게 증가시킬 수 있음을 확인하였고, 폐경기성 골다공증의 개선에 대한 운동 효과는 OPG 상향조절(up-regulation)과 밀접한 상관관계가 있음을 제안하였다. 또한, 규칙적인 운동은 혈중 OPG 농도에 영향을 미칠 수 있으며, 폐경 후 여성을 대상으로 12개월 동안의 운동중재는 혈중 OPG 농도를 유의하게 증가시키는 것으로 보고되었다(Bergstrom et al., 2012; West et al., 2009). 동물실험에서, Wang et al.(2014)은 6주간의 jump 운동이 흰쥐 경골에서 RANKL 및 OPG mRNA 발현을 증가시킬 수 있음을 보고하였고, Wang et al.(2013)은 난소절제 흰쥐를 대상으로 11주간 트레드밀 운동을 시킨 결과 대퇴골두 세포에서 OPG mRNA 발현이 유의하게 증가하였고 RANKL mRNA발현은 감소하였으나 유의한 차이는 없었다고 보고하였다. 이러한 결과는 본 연구에서도 나타났으며, OPG mRNA 발현에 있어 저항성 운동의 단일 형태보다는 복합운동의 처치가 더 유의한 효과를 보였으며, RANKL mRNA 발현 수준은 운동 형태에 관계없이 유의한 차이가 나타나지 않았다.
결론 및 제언
본 연구 결과를 종합해 볼 때, 골밀도 및 골대사 관련 요인의 개선을 위해서는 단일 형태의 운동보다는 적정한 운동 강도에 부합된 저항성 및 유산소 운동의 복합적 처치가 좀 더 효과적인 방법이라 판단된다. 또한 에스트로겐 결핍에 따른 골 대사 변화는 IL-1(interleukin-1, -6) 그리고 tumor necrosis factor-α (TNF-α)와 같은 골 용해성 cytokine 분비에 지대한 영향을 받는다는(Xia et al., 2019) 선행 연구를 감안할 때, 이들 요인에 대한 향후 추가적인 연구가 계속 진행되어야 할 것으로 생각된다.
이 논문은 2017년 대한민국 교육부와 한국연구재단의 지원을 받아 수행된 연구임 (NRF-2017S1A5A2A01023349)
References
Bolton, K. L., Egerton, T., Wark, J., Wee, E., Matthews, B., Kelly, A., Craven, R., Kantor, S., & Bennell, K. L. (2012). Effects of exercise on bone density and falls risk factors in post-menopausal women with osteopenia: a randomised controlled trial. Journal of Science Medicine in Sport, 15(2), 102-109.
Farr, J., Rowsey, J., Eckhardt, B., Thicke, B., Fraser, D., Tchkonia, T., Kirkland, J., Monroe, D., & Khosla, S. (2019). Independent roles of estrogen deficiency and cellular senescence in the pathogenesis of Osteoporosis: Evidence in young adult mice and older humans. Journal of Bone and Mineral Research, 34(8), 1407-1418.
Moreira, L. D., Oliveira, M. L., Lirani-Galvão, A. P., Marin-Mio, R. V., Santos, R. N., Lazaretti-Castro, M. (2014). Physical exercise and osteoporosis: effects of different types of exercises on bone and physical function of postmenopausal women. Arquivos Brasileiros Endocrinologia Metabologia, 58(5), 514-522.
Lee, J. W., Kim, H. J., Jhee, O. H., Won, H. D., Yu, Y. J., Lee, M. H., Kim, T. H., Om, A. S., & Kang, J. S. (2005). Effects of alternative medicine extract on bone mineral density, bone strength and biochemical markers of bone metabolism is ovariectomized rats. Korean Journal of Food and Nutrition, 18(1), 72-80.
Tartibian, B., Hajizadeh Maleki, B., Kanaley, J., & Sadeghi K. (2011). Long-term aerobic exercise and omega-3 supplementation modulate osteoporosis through inflammatory mechanisms in post-menopausal women: a randomized, repeated measures study. Nutrition & Metabolism , 8, 71. doi: 10.1186/1743-7075-8-71.
Tromp, A. M., Bravenboer, N., Tanck, E., Oostlander, A., Holzmann, P. J., Kostense, P. J., Roos, J. C., Burger, E. H., Huiskes, R., & Lips, P. (2006). Additional weight bearing during exercise and estrogen in the rat: the effect on bone mass, turnover, and structure. Calcified Tissue International, 79(6), 404-415.
van Geel, T. A., Geusens, P. P., Winkens, B., Sels, J. P., & Dinant, G. J. (2009). Measures of bioavailable serum testosterone and estradiol and their relationships with muscle mass, muscle strength and bone mineral density in postmenopausal women: a cross-sectional study. European Journal of Endocrinology, 160(4), 681-687.