 ISSN : 1598-2920
ISSN : 1598-2920
ⓒ Korea Institute of Sport Science
This is the first study to examine whether age impacts the response of single muscle fibers to high/low frequency and high/low volume electrical pulse stimulation. We performed in vitro experiments to evaluate the effect of low-frequency high-volume electrical pulse stimulation (EPS) on mechanistic target of rapamycin (mTOR), mitogen-activated protein kinase (MAPK) signaling pathway, and satellite cell activation in singles fibers of young and aged muscles.
Isolated single fibers from gastocnemius in 12-wk (n=21) and 72-wk (n=21) old male C57BL/6 mice were divided into four groups: 1) control (Con) received no EPS, 2) low-frequency low-volume EPS (LL), 3) low-frequency high-volume EPS (LH), and 4) high-frequency low-volume EPS (HL) were made to contract using independent EPS protocols. Satellite cell activation and anabolic pathway (mTOR and MAPK signaling) were measured before and after EPS.
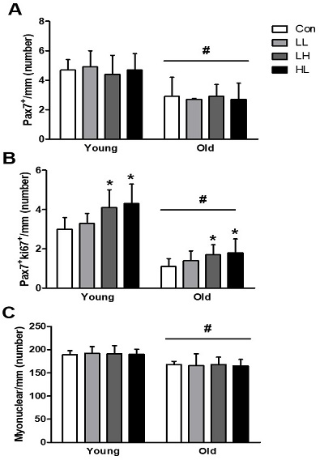
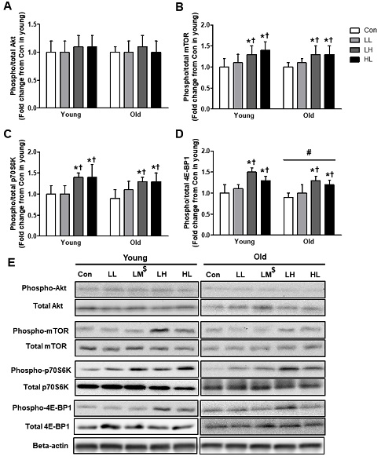
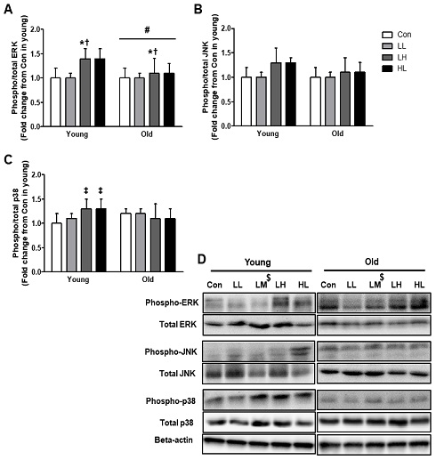
The number of quiescent (Pax7+/Ki67-) and active (Pax7+/Ki67+) satellite cells, myonuclear content and the phosphorylation of 4E-BP1 and ERK were higher in young when compared with old. However, regardless of age, LH and HL EPS significantly increased the number of activate satellite cells (142%, both) and phosphorylation of mTOR (129% and 133%, respectively), p70S6K (133% and 136%, respectively) and 4E-BP1 (140% and 129%, respectively) compared with Con. The protein expression of ERK phosphorylation only increased by LH EPS in both the young and old groups (123% and 125%, respectively).
이 연구는 저강도 고반복 저항성 근수축이 노화된 단일 근섬유의 위성세포 활성, mechanistic target of rapamycin (mTOR), mitogen-activated protein kinase (MAPK) 신호체계에 미치는 영향을 확인하였다.
12주령(젊은 집단, n=21)과 72주령(노화 집단, n=21)의 C57BL/6 마우스로부터 단일 근섬유를 분리 및 배양한 후 근수축 형태에 따른 영향을 분석하기 위하여 1) 전기자극을 시행하지 않은 통제집단(Con), 2) 저강도 저반복 전기자극 집단(LL), 3) 저강도 고반복 전기자극 집단(LH), 4) 고강도 저반복 전기자극 집단(HL)으로 무작위 배정하였다. 전기자극이 시행된 단일 근섬유는 조직면역화학염색을 이용하여 위성세포의 활성을 분석하였으며, western-blotting을 실시하여 단백질 합성 신호체계의 인산화를 분석하였다.
Quiescent 위성세포(Pax7+Ki67-), 활성 위성세포(Pax7+Ki67+), 근 핵의 숫자와 4E-BP1, ERK의 인산화 정도는 노화 집단이 젊은 집단에 비해 유의하게 낮았다(p<.05). 그러나 연령에 상관없이 LH와 HL 전기자극은 Con 집단보다 위성세포의 활성(142%, both)과 mTOR (129% and 133%, respectively)와 p70S6K (133% and 136%, respectively), 4E-BP1 (140% and 129%, respectively)의 인산화를 유의하게 증가시켰다(p<.05). ERK의 인산화는 젊은 집단과 노화 집단 모두 오직 LH 전기자극에 의해서만 증가 되었다(123% and 125%, respectively).
근육량을 적절하게 유지하는 것은 골격근의 수축과 이완작용에 의한 움직임뿐만 아니라 인슐린 저항성, 에너지의 저장과 소비 등 전반적인 인체 대사 및 사망률과 매우 밀접한 관련이 있다(Stump et al., 2006). 노인성 근감소증(sarcopenia)은 노화로 인해 나타나는 대표적인 골격근 쇠퇴 현상으로, 골격근 동화작용에 저항성(anabolic resistance)을 증가시키고, 단백질 분해 대사의 기능 이상을 유발하는 등 노화로 인한 근육량 및 기능의 급격한 감소를 나타낸다(Rosenberg, 1997). 일반적으로, 저항성 운동은 serine- /threonine- kinase인 mechanistic target of rapamycin (mTOR)와 mitogen-activated protein kinase (MAPK) 의 단백질 신호체계를 활성시켜 골격근량을 효과적으로 증가시킨다(Laplante & Sabatini, 2012; Sengupta et al., 2010). mTOR는 단백질 합성을 위한 대표적인 신호체계로 그 하위 단백질 신호인 ribosomal protein S6 kinase(p70S6K)와 eukaryotic translation initiation factor 4E binding protein 1 (4E-BP1)을 인산화시킴으로써 단백질 합성을 조절한다(Laplante & Sabatini, 2012). MAPK는 extracellular signal-regulated kinase(ERK) 1/2와 p38 MAPK, c-JUN NH2-terminal kinase (JNK)로 운동이나 신체활동 등 근수축에 의해 활성 되어 골격근의 세포주기를 조절한다(Williamson et al., 2003). 뿐만 아니라 저항성 운동은 골격근의 줄기세포인 위성세포(satellite cell)를 대기 상태(quiescent)에서 활성화하여 위성세포의 증식과 분화를 유도함으로써 골격근의 재생과 성장에 관여한다(Joanisse et al., 2017). 따라서 위의 요인들을 고려하여 노화에 의해 나타나는 골격근의 부정적 적응 현상을 억제하기 위한 효과적인 저항성 운동방법의 제안이 요구된다.
단일 근섬유(single fiber)나 근원세포(myoblast)와 같은 in vitro 모델은 골격근의 분자생물학적인 기전연구에 유용하게 사용되며(Park et al., 2015; Nikolic et al., 2017; Carter & Solomon, 2019), 전기자극(electrical pulse stimulation, EPS)은 배양된 골격근 세포에 골격근 수축과 유사한 적응 현상을 유도한다(Nikolic et al., 2017). 뿐만 아니라 근 신경학적 논리를 기반으로 전기자극의 빈도(frequency)와 시간(duration)을 조절함으로써 지속적인 저빈도(low-frequency) 전기자극은 지근성 근섬유의 수축을 유도하고, 짧은 시간의 고빈도(high-frequency) 전기자극은 속근성 근섬유의 수축이 활성 됨을 확인하였다(Henning & Lømo, 1985; Naumann & Pette, 1994). 선행연구들에 의하면 배양된 근관세포(myotube)에 처치된 전기자극의 빈도와 시간의 설정에 따라 저빈도 전기자극은 미토콘드리아 관련 단백질 발현의 증가 등 지구성 운동과 유사한 효과가 나타났으며(Lambernd et al., 2012; Nikolic et al., 2012), 고빈도 전기자극은 단백질 합성 신호체계의 인산화와 같은 저항성 운동과 유사한 적응 현상을 보고하였다(Donnelly et al., 2010; Scheler et al., 2013).
지금까지 근 비대(hypertrophy)를 위한 저항성 운동방법으로 1RM (repetition maximum)의 70% 이상의 고강도 저항성 운동 protocol이 제안되어 왔다(American college of sport et al., 2009). 그러나 최근 연구들은 1RM의 30%인 저강도 중량으로 고반복 저항성 운동 시 고강도 저항성 운동과 동일한 근 비대 효과가 나타남을 보고하고 있다(Schoenfeld et al., 2017; Lim et al., 20019). Burd et al. 은 젊은 성인들을 90%RM (고강도)와 30%RM (저강도) 집단으로 나누어 일회성 leg extension (4 sets)을 set당 더는 반복할 수 없을 때(set to failure; 고반복)까지 실시하여 대퇴 사두근의 골격근 단백질 합성률(muscle protein synthesis, MPS)을 확인한 결과 두 집단 간 차이가 없음을 보고하였다(Burd et al., 2010). 또한, Mitchel et al.은 젊은 성인들을 대상으로 10주간(3회/주)의 저강도 고반복 저항성 운동과 고강도 저항성 운동을 시행하여 두 집단 모두 근 횡단면적이 증가하였으며, 두 집단 간 증가율에 차이가 없음을 확인하였다(Mitchel et al., 2012). 저강도 저항성 운동은 고강도 운동을 시행하기 어려운 노인들과 회복기의 근 골격계 상해 환자들을 대상으로 더욱 효과적으로 활용될 수 있음에도 불구하고, 취약한 대상자들을 고려하여 지금까지 대부분의 저강도 고반복 운동에 대한 연구는 젊은 피험자들을 대상을 실시되었다. 따라서, 노화된 단일 근섬유를 이용하여 저빈도 고반복 전기자극의 효과를 검증하는 것은 노인들을 대상으로 저강도 고반복 저항성 운동에 대한 효과를 검증하기 전 유용한 사전 연구가 될 것이다.
노화는 운동, 영양 등 골격근 단백질의 합성을 유도하는 요인들의 반응성을 감소시키는 동화작용 저항성(anabolic resistance)을 유발한다(Burton & Smukadas, 2010). 뿐만 아니라 노화된 골격근의 위성세포는 외부 자극에 의한 증식이나 분화 등 대사의 활성이 젊은 개체의 골격근 위성세포에 비해 감소함이 확인되었다(Snijders et al., 2014; Suetta et al., 2013). 그럼에도 불구하고 저항성 운동과 적절한 단백질 섭취는 노인들의 단백질 합성(MPS)을 효과적으로 증가시켰다(Yang et al., 2012). 따라서 in vitro 실험을 통해 외적인 요인들을 철저히 통제한 후 저강도 고반복의 근 수축형태가 노화된 골격근 대사에 미치는 기전을 확인하는 것은 추후 노인을 위한 새로운 운동방법을 제안하기 위한 중요한 자료가 될 것이다.
이 연구는 젊은 쥐와 노화 쥐로부터 단일 근섬유를 분리 후 배양하였으며, 배양된 단일 근섬유에 전기자극을 통해 저강도 고반복 근수축을 실시하였다. 실시된 저강도 고반복 전기자극이 배양된 단일 근섬유의 mTOR와 MAPK 단백질 신호체계, 위성세포의 활성에 어떠한 영향을 미치는지 분석하였으며, 노화에 의한 기전적 차이를 젊은 집단과 비교 분석하였다.
이 실험에 사용된 단일 근섬유는 유사한 형질을 위해 한배 암컷과 수컷이 동종 교배된 12주령(젊은 집단, n=21)과 72주령(노화 집단, n=21)의 C57BL/6 수컷 쥐의 비복근으로부터 분리되었다. 모든 실험동물은 단일 근섬유 배양을 위해 희생되기 직전까지 온도(22±2℃), 습도(50~60%) 및 명암조명(12시간, 명; 12시간, 암)이 일정하게 유지된 동물실에서 사육되었으며, 동물 윤리와 관련된 모든 사항은 동물실험윤리위원회로부터 승인받은 후 실시되었다(KNSU-IACUC-2017-03).
목등뼈 탈골을 실시하여 실험동물을 희생시킨 직후 비복근을 적출 하여 0.2% type I collagenase가 포함된 high glucose Dulbecco’s Modified Eagle’s medium (DMEM) buffer에 넣은 뒤 2시간 동안 37℃의 water bath에서 적절한 shaking과 함께 반응시켰다. Collagenase의 충분한 반응이 일어나면 단일 근섬유의 분리가 일어나게 되고 완전히 분리된 단일 근섬유들은 지근과 속근의 구분없이 DMEM-10% FBS (fetal bovine serum)와 10% horse serum이 들어있는 Petri dish로 옮긴 후 CO2 incubator(5%, 37℃)에서 overnight incubation을 실시하였다. 다음날, pasture pipette를 이용하여 손상되지 않은 단일 근섬유를 분리하고 다시 37℃의 CO2 incubator (5%) 에서 overnight incubation 하여 단일 근섬유의 안정성을 확보한 후 전기자극을 실시하였다(Rosenblatt et al., 1995).
단일 근섬유는 Henning & Lømo 와 Liu et al. 의 방법을 수정하여 전기자극을 실시하였다(Henning & Lømo, 1987; Liu et al., 2001). 분리된 약 30~40개의 단일 근섬유는 6 well plate 중 1개 well에 DMEM buffer와 함께 분주한 뒤 전기자극기(DS2A mk2, Herfordshire, England)를 이용하여 37℃의 CO2 incubator (5%) 안에서 설정된 집단에 따라 주어진 전기자극 protocol을 실시하였다.
단일 근섬유의 근수축 강도와 시간에 따른 단백질 합성 및 위성세포의 활성에 미치는 영향을 비교하기 위하여, 1) 전기자극을 시행하지 않은 통제집단(Con), 2) 저강도 근수축을 유도하기 위해, 저빈도 주파수인 10Hz로 1회 전기자극 시 5초간 지속 되며 자극의 간격은 10초로 설정하여 총 3분간 짧은 전기자극을 시행한 저강도 저반복 집단(low-frequency low-volume, LL), 3) 저빈도 주파수인 10Hz로 1회 전기자극 시 5초간 지속 되며, 자극의 간격은 10초로 총 20분의 전기자극을 시행한 저강도 고반복 집단(low-frequency high-volume, LH), 4) 고강도 근수축을 유도하기 위해, 고빈도 주파수인 50Hz를 사용하였으며, 1회 전기자극 시 1초 동안 지속하며 10초의 자극 간격으로 2분간 전기자극을 시행한 고강도 저반복 집단(high-frequency, low-volume, HL)의 총 4 집단을 설정하였다. 근수축 강도만의 차이를 검증하기 위하여 LL 집단과 HL 집단 간에는 총 전기자극량(total electrical stimulation)이 같아지도록 전기자극을 시행하였다. 집단에 따른 전기자극의 방법은 <Table 1>과 같다. 모든 집단은 전기자극 후 CO2 incubator (5%, 37℃)에서 3시간의 휴식기를 갖은 후 분석을 시행하였다.
| Electrical stimulation (s-1) | Pulse duration (s) | Rest interval (s) | Time (min) | Total electrical stimulation (reps*s-1) | |
|---|---|---|---|---|---|
| Con | - | - | - | - | - |
| LL | 10 | 5 | 10 | 3 | 600 |
| LH | 10 | 5 | 10 | 20 | 4000 |
| HL | 50 | 1 | 10 | 2 | 600 |
주어진 전기자극 후 3시간의 휴식기가 끝나면 표현형 분석을 위해 4% paraformaldehyde (PFA)로 5분간 단일 근섬유를 고정했다. 단일 근섬유의 고정이 마쳐지면, 0.1M phosphate-buffered saline (PBS)으로 10분간 washing 한 후 10% donkey serum (D9663, Sigma, USA)으로 20분간 blocking을 실시했다. Blocking이 마쳐지면, 위성세포의 활성을 분석하기 위하여 quiescent 위성세포 marker인 anti-Pax7 (MAB 1675, R&D systems, USA)와 위성세포 활성 marker인 anti-Ki67 (ab16667, abcam, England)를 1% BSA/TPBS 용액(0.1M PBS, 1% bovine serum albumin and 0.1% triton X-100)과 1:100으로 dilution 하여 단일 근섬유와 함께 4℃에서 overnight incubation 시켰다. 다음날, 0.1% TPBS로 10분간 washing을 실시한 후 2차 항체인 Alexa fluor 488 donkey anti-mouse IgG antibody (MOP-A-21202, Life technologies, USA)와 Alexa fluor 594 donkey anti-rabbit IgG antibody (MOP-A-21207, Life technologies, USA)를 1% TPBS/BSA와 1:500으로 dilution하 여 상온에서 4시간 동안 incubation 시켰다. 2차 항체 incubation이 마쳐지면 0.1% TPBS로 washing 한 후 마지막으로 4,6-diamidino-2 phenylindole (DAPI)가 섞여 있는 mounting medium을 사용함으로써 근 핵을 염색하였다.
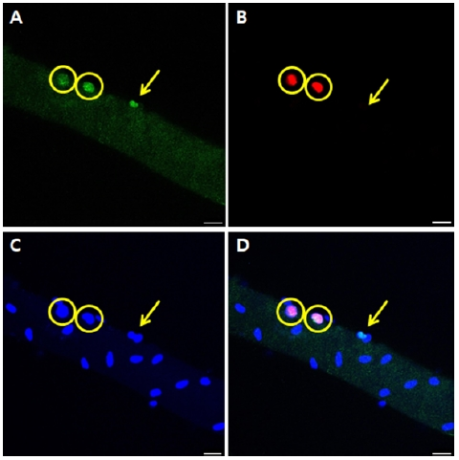
염색된 단일 근섬유는 Leica TCS SP8 confocal 현미경(Leica Micro system, Germany)을 이용하여 이미지를 촬영하였으며, Leica application suite with advanced fluorescence (LAS AF) 소프트웨어를 사용하여 이미지를 분석하였다. 얻어진 이미지는 <Figure 1>과 같으며, 근 핵은 염색된 DAPI (파란색)의 숫자를 개수하였고, quiescent 위성세포는 Pax7+/Ki67-(초록색), active 위성세포는 Pax7+/ Ki67+ (초록색과 빨간색)으로 구분하였다(Mackey et al., 2009). 단일 근섬유의 길이는 <Figure 2>와 같이 differential interference contrast (DIC) image로 촬영하였으며, 형광이미지 분석과 동일한 LAS AF 소프트웨어를 사용하여 분석하였다. 단일 근섬유의 길이는 각 섬유의 끝에서 끝의 길이를 LAS AF 길이 측정 tool을 이용하여 측정하였다. 근절의 길이는 각 단일 근섬유의 3부분을 무작위로 선정하여 각 부분에서 10개의 근절 길이를 측정한 뒤 3부분의 모든 값을 합하여 평균 수치를 값으로 사용하였다. 하나의 표본 값을 얻기 위하여 최소 10개의 단일 근섬유를 분석하였으며, 그 평균값을 수치로 사용하였다.
전기자극을 시행하고 3시간의 휴식기 후 약 20~25개의 단일 근섬유를 protease와 phosphatase inhibitor cocktail (78440, Thermo Fisher Science, USA)이 첨가된 lysis buffer [25mM Tris-Cl (pH 7.5), 250mM NaCl, 5mM EDTA, 1% NP-40, 1mM phenymethylsulfony1 fluoride (PMSF), 5mM dithiothreitol (DTT)]에 넣어 4℃에서 30분간 작용시킨 후 10분간 14,000rpm으로 원심분리를 시행하였다. 원심분리 후 얻어진 상층액은 BCA protein assay (23225, Thermo Fisher Science, USA)를 실시하여 단백질 농도를 측정하였고, 5-12%의 SDS- polyacrylamaide gel에 모든 표본이 같은 양의 단백질을 갖도록 분주하였다. 표본 분주가 완료되면 80 volt에서 약 120분간 전기영동을 실시하였고, 전기영동이 끝마쳐지면 80-110 volts에서 90분간 nitrocellulose membrane (Life Science, Germany)으로의 단백질 transfer를 실시하였다. Transfer가 완료된 membrane은 5% BSA 용액에 2시간 blocking 시킨 후 1차 항체인 protein kinase B (Akt, 9272s, Cell Signaling, 1:1000), phospho-AktSer473 (9271s, Cell Signaling, 1:1000), mTOR (2972s, Cell Signaling, 1:1000), phospho-mTORSer2448 (2971s, Cell Signaling, 1:1000), p70S6K (9202s, Cell Signaling, 1:1000), phospho-p70S6KThr389 (9205s, Cell Signaling, 1:1000), 4E-BP1 (9452s, Cell Signaling, 1:1000), phospho-4E-BP1Thr37/46 (9459s, Cell Signaling, 1:1000), ERK (4695s, Cell Signaling, 1:1000), phospho-ERKThr202/Tyr204 (9101s, Cell Signaling, 1:1000), JNK (9252s, Cell Signaling, 1:1000), phospho-JNKThr183/Tyr185 (4671s, Cell Signaling, 1:1000), p38 (9212s, Cell Signaling, 1:1000), phospho-p38Thr180/Tyr182 (9211s, Cell Signaling, 1:1000), β-actin (sc-47778, Santa Cruz, 1:1000)을 blocking 용액과 dilution 하여 4℃에서 overnight incubation 시켰다. 다음날, TBS-T 용액으로 10분간 washing 한 후 2차 항체인 horseradish peroxidase (HRP) conjugated goat anti-rabbit (65-6120, ZYMED, 1:5000)과 anti-mouse (sc-2005, Santa Cruz, 1:5000)를 각 1차 항체에 맞도록 배치하여 상온에서 90분간 incubation 하였다. 2차 항체 incubation이 마쳐지면 TBS-T 용액으로 10분간 washing 한 후 WBLR solution (Luminata Crescendo Western HRP Substrate, Millipore, USA) 처리 후 이미지 분석 시스템(Molecular image ChemiDox XRS system, Bio-Rad, USA)로 밴드를 촬영하였다. 얻어진 밴드는 Quantity One 1-D Analysis Software (Bio-Rad, USA)를 이용하여 분석하였다(Burnette, 1981).
이 연구는 1회의 experiment를 위해 각 3마리의 젊은 쥐와 노화 쥐로부터 단일 근섬유를 배양하였으며, 총 7회의 experiment를 실시하였다. 각 experiment 당 최소 250개 이상의 단일 근섬유를 배양하였으며, 배양된 단일 근섬유는 설정된 4개의 집단에 약 30~35개씩 무작위 배정하여 전기자극을 시행하였다. 전기자극 후 약 10개의 단일 근섬유는 조직면역화학염색에 의한 분석을 실행하였으며, 얻어지는 결과값의 평균을 하나의 표본 값으로 사용하였고, 약 20~25개의 단일 근섬유는 western blotting에 의해 분석되었다. 이렇게 측정된 모든 변인의 값은 SPSS/PASW statics 18.0 통계 프로그램을 이용하여 평균(mean)과 평균의 표준오차(SEM)로 제시하였다. 변인들은 집단(group)과 연령(age)에 따른 상호작용 및 주 효과를 분석하기 위하여 이원 변량분석 (two-way ANOVA)를 실시하였으며, 사후 검증을 위해 Tukey HSD가 실시되었다. 통계적 유의 수준은 α=.05로 설정하였다.
단일 근섬유와 근절의 길이 결과는 <Table 2>와 같다. 단일 근섬유(age*group, df=3, F=1.9, p=.155)와 근절(age*group, df=3, F=1.6, p=.207)의 길이는 집단이나 연령 따른 상호작용이 없었으며, 연령(단일 근섬유, df=1, F=1.8, p=.177; 근절, df=1, F=2.0, p=.153)이나 집단(단일 근섬유, df=3, F=2.9, p=.090; 근절, df=3, F=1.8, p=.19)에 의한 차이도 없었다.
| Group | Con | LL | LH | HL | |
|---|---|---|---|---|---|
| Fiber length (㎛) |
Young | 3870±60 | 3708±125 | 3678±200 | 3698±245 |
| Old | 3790±87 | 3798±152 | 3658±219 | 3512±201 | |
| Sarcomere length (㎛) |
Young | 2.3±0.2 | 2.2±0.3 | 2.1±0.3 | 2.1±0.4 |
| Old | 2.5±0.5 | 2.4±0.3 | 2.3±0.6 | 2.3±0.5 |
Quiescent 위성세포(Pax7+/ki67-), 활성 위성세포(Pax7+/ki67+), 근 핵은 단일 근섬유 1mm당 개수로 나타냈으며, 결과는 <Figure 3>과 같다. Quiescent 위성세포(age, df=1, F=84.3, p<.001), 활성 위성세포(age, df=1, F=15.9, p<.001), 근 핵(age, df=1, F=39.8, p<.001)의 수는 젊은 집단이 노화 집단보다 유의하게 많았다. Quiescent 위성세포(group, df=3, F=.578, p=.680)와 근 핵(group, df=3, F=.038, p=.997)의 수는 각 집단에 설정된 전기자극에 의한 차이가 없었지만, 활성 위성세포의 수(group, df=3, F=8.015, p<.001)는 LH 집단이 145% (p<.001), HL 집단이 150% (p=.004) Con 집단에 비해 많았다.
mTOR 단백질 신호체계는 total 단백질에 대한 인산화의 정도로 나타냈으며(phospho-/total-, p/t), 그 결과는 <Figure 4>와 같다. 전기자극 후 p/t Akt는 집단이나 연령 간에 상호작용 또는 주 효과가 나타나지 않았다(group*age, df=3, F=.029, p=.993; group, df=3, F=.665, p=.577; age, df=1, F=.068, p=.795). p/t mTOR의 발현은 연령에 상관없이 LH와 HL 집단이 Con 집단보다 각각 129% (p<.001), 133% (p<.001) 높았고, LL 집단보다 118% (p=.008), 121% (p=.001) 높았다(group, df=3, F=14.5, p<.001). p/t p70S6K는 연령에 상관없이 LH와 HL 집단이 Con 집단보다 각각 133% (p<.001), 136% (p=.002) 높았고, LL 집단보다 126% (p<.001), 128% (p<.001) 높았다(group, df=3, F=13.6, p<.001). p/t 4E-BP1은 젊은 집단이 노화 집단보다 105% 발현량이 높았으며(age, df=1, F=6.0, p=0.17), 연령에 상관없이 LH와 HL 집단이 Con 집단보다 140% (p<.001), 129% (p<.001) 높았고, LL 집단보다 138% (p<.001), 127% (p<.001) 발현량이 높았다(group, df=3, F=30.2, p<.001).
MAPK 단백질 신호체계는 total 단백질에 대한 인산화의 정도로 나타냈으며(phospho-/total-, p/t), 그 결과는 <Figure 5>와 같다. 전기자극 후 p/t JNK는 집단이나 연령 간에 상호작용 또는 주 효과가 나타나지 않았다(group*age, df=3, F=1.5, p=.239; group, df=3, F=.1.6, p=.211; age, df=1, F=3.7, p=.059). p/t ERK는 젊은 집단이 노화 집단보다 109% 발현량이 높았으며(age, df=1, F=5.4, p=0.25), 연령에 상관없이 LH 집단이 Con 집단보다 123% (p=.015), LH 집단보다 125% (p=.008) 높았다(group, df=3, F=6.0, p=.001). p/t p38은 집단과 연령 간에 상호작용이 있었으며(df=3, F=5.1, p=.003), 사후 검증 결과 젊은 집단에서 LH와 HL 집단이 Con 집단보다 각각 129% (p=.021), 130% (p=.018) 단백질 발현이 증가되었다.
최근 선행연구들은 고강도 저항성 운동뿐만 아니라 저강도 고반복 저항성 운동에 의해서도 골격근의 비대가 나타남을 보고하고 있다(Schenfeld et al., 2017; Lim et al., 2019). 이러한 저강도 저항성 운동은 고강도 운동을 수행하기 어려운 노인이나 신체 허약자들에게 적용 가능한 운동방법임에도 불구하고, 노인을 대상으로 저강도 고반복 근수축이 골격근의 대사에 미치는 영향을 분석한 연구는 많이 부족한 실정이다. 따라서 이 연구는 노화된 단일 근섬유를 배양하여 저강도로 장시간 근수축을 시켰을 때 나타나는 골격근 비대 관련 기전을 분석하는 데 목적이 있었다. 연구 결과, 노화 집단의 단일 근섬유는 젊은 집단에 비해 quiescent 위성세포와 활성 위성세포, 그리고 근 핵의 숫자가 유의하게 적었으며, ERK의 인산화 발현량이 적었다. 그러나 연령에 상관없이 저강도 고반복 전기자극(LH)과 고강도 저반복 전기자극(HL)에 의해 위성세포의 활성이 증가 되었고 mTOR, p70S6K, 4E-BP1의 인산화가 증가됨을 확인하였다. ERK의 인산화는 연령에 상관없이 오직 LH 전기자극에 의해서만 증가되었으며, p38의 인산화는 젊은 집단의 단일 근섬유에서만 LH와 HL 집단에 의해 증가됨을 확인하였다.
위성세포는 골격근에 존재하는 줄기세포로, 활성 된 위성세포는 증식과 분화의 과정을 거쳐 손상된 근육세포를 재생시키거나 새로운 근 핵을 제공함으로써 골격근의 재생과 성장에 관여한다. 또한, 증식된 위성세포는 다시 quiescent 상태로 돌아가는 자가재생(self-renewal)과정을 거치기도 한다(Verdijk et al., 2014). 인간을 대상으로 진행된 많은 선행연구는 저항성 운동에 의해 위성세포가 증식되며, 이렇게 증가 된 위성세포 수가 근 비대에 밀접하게 관련되어 있음을 보고하고 있다(Joanisse et al., 2020). 이 연구는 LH와 HL 전기자극이 연령과 상관없이 위성세포를 활성화함을 확인하였다. 그러나 LL 집단의 경우 LH 집단과 같은 저강도 전기자극임에도 불구하고 짧은 시간의 전기자극은 위성세포를 효과적으로 활성화하지 못하였다. 이 연구결과와 같이, Lim et al. 은 12주령의 rat을 이용하여 사다리 운동을 시행한 결과 저강도 저반복 사다리 오르기 운동은 위성세포의 활성을 증가시키지 못하였지만, 저강도 고반복의 사다리 오르기 운동은 위성세포의 활성을 증가시켰으며, 고강도 저반복 사다리 운동 집단과 차이가 없음을 보고하였다(Lim et al., 2020). 이 연구 결과들을 통해 위성세포의 활성을 위해서는 HL과 같이 고강도 자극에 의한 강력한 수축이 일어나거나, LH와 같이 저강도 근수축이라도 고반복 되어야 함을 나타낸다. 또한 저강도 저항성 운동에 의해 근 비대를 유도하기 위해서는 고반복이 동반되어야 한다는 선행연구들과 일치하였다(Schenfeld et al., 2014; Lim et al., 2019). 흥미로운 점은 노인 집단의 단일 근섬유에서 quiescent 위성세포와 활성 위성세포, 근 핵의 수가 젊은 집단에 비해 유의하게 적음에도 불구하고, LH와 HL 전기자극이 노화 집단의 위성세포 활성을 효과적으로 증가시켰다. 위성세포와 근 핵 수의 감소는 노화에 의해 나타나는 부정적인 적응 현상이다(Verdjk et al., 2014). 그럼에도 불구하고, 이 연구 결과는 장시간 저강도 전기자극을 통해 노화 집단의 위성세포 활성이 증가 됨을 보고함에 따라 저강도 고반복 저항성 운동이 노인들의 위성세포 활성을 증가시킴으로써 노인성 근감소증에 긍정적인 영향을 미칠 가능성을 제시하고 있다.
mTOR 단백질 신호체계는 골격근 단백질의 합성과 분해를 조절하는 중요한 신호 전달 기전이다(Laplante & Sabatini, 2012). mTOR 신호체계는 mTOR의 상위 조절인자인 Akt가 인산화되어 나타나거나 운동과 같은 mechanical 자극에 의해 활성 된다(Spangenburg et al., 2008). 이 연구는 연령에 상관없이 LH와 HL 전기자극이 mTOR의 인산화를 증가시켰지만, 그 상위조절 인자인 Akt의 인산화에는 차이가 없었다. 이 결과는 mTOR의 인산화가 Akt와는 독립적으로 운동이나 전기자극과 같은 mechanical 자극으로 활성 될 수 있다는 선행연구와 같았다(Hornberger et al., 2004; O’Neal et al., 2009). 그러나 Akt의 인산화는 주로 운동 자극 직후 증가 되어 운동 후 3시간이 지난 시점에서는 baseline으로 돌아감이 보고됨에 따라(Ogasawara et al., 2016), 이 연구의 분석 시점인 전기자극 3시간 후에는 Akt의 인산화를 확인하는 것이 어려웠을 가능성이 있다. mTOR의 인산화는 그 하위 인자인 p70S6K와 4E-BP1의 인산화를 증가시켜 단백질 합성을 조절한다(Vandenburgh et al., 1991). 본 연구 결과는 젊은 집단과 노화 집단 모두 LH와 HL 전기자극에 의해 p70S6K와 4E-BP1이 증가함을 확인하였다. 이 연구결과는 젊은 사람들을 대상으로 일회성 저강도 고반복 저항성 운등을 실시하여 증가된 p70S6K와 4E-BP1 인산화를 보고한 선행연구와 일치하였으며(Burd et al., 2010), 12주령 rat을 이용한 일회성 저강도 고반복 사다리 오르기 운동에서도 증가 된 mTOR와 p70S6K, 4E-BP1의 인산화가 보고 되었다(Lim et al., 2020). 저항성 운동에 의해 증가한 p70S6K의 인산화는 근원섬유 단백질 합성(myofibrillar protein synthesis, MPS)과 매우 밀접한 상관관계가 있다(Kumar et al., 2009). 따라서 장시간 저강도 근수축에 의해 젊은 집단뿐만 아니라 노화 집단의 mTOR 단백질 신호체계가 효과적으로 인산화됨에 따라 저강도 고반복 저항성 운동이 노인들을 대상으로 골격근의 단백질 합성을 증가시킬 가능성을 제시하고 있다. ERK, JNK, p38으로 구성된 MAPK는 다양한 myogenic 전사인자들의 활성을 조절하여 위성세포의 증식, 분화, 자가재생의 조절에 관여한다(Osman et al., 2000; Lluis et al., 2006). 선행연구는 젊은 남성들을 대상으로 사이클 운동과 저항성 운동을 실시하여 ERK의 발현이 운동강도뿐만 아니라 골격근의 수축 횟수에 의해 증가 됨을 보고하였다(Williamson et al., 2003; Burd et al., 2010). 이 연구는 제시된 선행연구와 같이 연령에 상관없이 장시간 근수축을 반복한 LH 전기자극이 ERK의 인산화를 증가시킴을 확인하였다. 이 연구 결과는 ERK의 인산화가 운동의 강도보다는 근수축 횟수에 의해 증가 될 수 있음을 뒷받침하는 추가적인 자료가 될 수 있다. 그러나 노인 집단의 경우 LH에 의해 ERK의 인산화가 증가 되었지만 젊은 집단에 비해 그 발현 정도가 유의하게 낮았다. 뿐만 아니라, p38의 인산화 역시 LH, HL 전기자극을 시행한 젊은 집단의 단일 근섬유에서만 증가하였다. 노화는 안정 시 tumor necrosis factor α (TNFα), Interleukin 1 (IL-1) 등과 같은 염증성 cytokine들의 발현량을 증가시킨다(Paolisso et al., 1988; Kirwan et al., 2001). 이는 안정 시 MAPK의 인산화를 증가시켜(Raingeaud et al., 1995), 전기자극으로 인한 추가적인 외부적 요인에 의한 반응성을 감소시켰을 가능성이 있다. 이 결과들은 장시간 저강도의 근수축이 노인 집단의 ERK 인산화를 증가시켰지만, MAPK 단백질 신호체계들은 노화에 의해 다소 그 반응성이 낮아져 있음을 확인할 수 있었다.
이 연구의 제한점으로는 고강도와 저강도 근수축 효과를 검증하기 위해 사용된 전기자극 방법이 여러 선행연구를 통해 다양한 운동강도의 적용이 가능함이 보고되고 있지만, in vivo 모델(human)과 완벽하게 동일시할 수는 없다. 따라서 이 연구 결과를 기반으로 하여, in vivo 노화 모델에 의한 저강도 고반복 저항성 운동의 효과를 검증할 필요성이 있다. 또한, 이 연구에서 분석된 단일 근섬유는 지근과 속근성 근섬유를 구분하지 않았기 때문에 각 근섬유의 독립적인 효과는 확인할 수 없었다.
이 연구는 고강도 운동을 수행하기 어려운 노인이나 신체 허약자들을 위해 저강도 고반복 저항성 운동이 근 비대를 위한 효과적인 대안이 될 가능성을 검증하기 위해 실시되었다. 노화된 단일 근섬유는 젊은 집단에 비해 적은 위성세포와 근 핵 수, 낮은 단백질 합성 신호체계의 인산화 등 전반적으로 쇠퇴 된 근섬유 특성을 나타냈다. 그러나 저강도 고반복 전기자극에 의한 근수축은 노화된 단일 근섬유의 위성세포와 mTOR 단백질 신호체계를 효과적으로 활성화했다. 따라서 이 연구 결과는 저강도 고반복 저항성 운동이 젊은 대상자뿐만 아니라 노인의 골격근 대사에 긍정적인 영향을 미칠 가능성을 제시하며, in vivo 노화 모델을 이용한 추가적인 연구가 필요할 것으로 생각된다.
이 논문은 2017년 대한민국 교육부와 한국연구재단의 지원을 받아 수행된 연구임(NRF-2017S1A5A2A01024983).
American College of Sports Medicine, Chodzko-Zajko, W. J., Proctor, D. N., Fiatarone Singh, M. A., Minson, C. T., Nigg, C. R., Salem, G. J., Skinner, J. S. (2009) American College of Sports Medicine position stand. Exercise and physical activity for older adults. Med Sci Sports Exerc. 41(7):1510-30.
Burd, N. A., West, D. W., Staples, A. W., Atherton, P. J., Baker, J. M., Moore, D. R., Holwerda, A, M,. Parise, G., Rennie, M. J., Baker, S. K., Phillips, S. M. (2010). Low-load high volume resistance exercise stimulates muscle protein synthesis more than high-load low volume resistance exercise in young men PLoS One, 5(8):e12033.
Kumar, V., Selby, A., Rankin, D., Patel, R., Atherton, P., Hildebrandt, W., Williams, J., Smith, K., Seynnes, O., Hiscock, N., Rennie, M. J. (2009). Age-related differences in the dose-response relationship of muscle protein synthesis to resistance exercise in young and old men. J Physio,. 587(1):211-7.
Lambernd, S., Taube, A., Schober, A., Platzbecker, B., Görgens, S. W., Schlich, R., Jeruschke, K., Weiss, J., Eckardt, K., Eckel, J. (2012). Contractile activity of human skeletal muscle cells prevents insulin resistance by inhibiting pro-inflammatory signalling pathways. Diabetologia, 55(4):1128-39.
Suetta C., Frandsen U., Mackey A. L., Jensen L., Hvid L. G., Bayer M. L., Petersson S. J., Schrøder H. D., Andersen J. L., Aagaard P., Schjerling P., Kjaer M.. (2013). Ageing is associated with diminished muscle re-growth and myogenic precursor cell expansion early after immobility-induced atrophy in human skeletal muscle. J Physiol, 591(15):3789-804.